Plazmové myší nádory. role Polyribosomes v biosyntéze imunoglobulinů
1. plazmocytom mnohem více homogenní v jeho složení, v tomto pořadí, a proteiny produkované nich jsou více homogenní než běžné imunoglobuliny nebo protilátky. Je třeba poznamenat, že idea homogenity myelomových buněk nepotřebují absolutní. Ve skutečnosti je každé plazmocytom (stejně jako jakýkoli buněčný klon) je kolekce buněk v různých stádiích diferenciace, a provádět různé funkce. Zdá se, že i jejich díla nejsou stejné.
Například, mohou být imunoglobuliny detekovány pouze u 50% buněk, plazmocytom H5563 (Rifkind např. A., 1962). Anti-idiotypové sérum na protein MOPC 315 řídí vysrážení ne více než 50% z imunoglobulinu secernovaného buňkami (Sirisinha, Eisen, 1971). Lidské monoklonální makroglobulin komponenty detekovány rozdíly v primární struktuře H- a L-řetězce (Hannestad, Sletten, 1971). Konečně, nedávno objevené fenotypové změny myelomové proteiny (Hausman, ROSMA, 1975).
2. Navzdory skutečnosti, že relativní Syntéza imunoglobulin v myelomových buňkách, není větší, než je ve slezině, a to zejména v mízních uzlin imunizovaných zvířat (Becker e. a., 1970) přesazeny myelom umožňují získat mnohem větší množství materiálu pro analýzu (hmotnost na nádor transplantovaný pod kůži myší může dosáhnout 1 / 3 hmotnosti zvířete, zatímco hmotnost sleziny nepřekročí 0,2 g).
3. Konečně, v řadě případů v buňkách plasmacytomy nukleázovou aktivitou je nižší než ve slezině nebo lymfatických uzlin z imunizovaných zvířat, a některé z nich i zřejmě obsahuje inhibitor RNasy, která je známá výhody při frakcionované buněk a izolací je z polyribosomes. To vše učinil hlavním předmětem plasmocytom studium mechanismů syntézy a montáž polypeptidových řetězců imunoglobulinů.

role Polyribosomes v biosyntéze imunoglobulinů
výzkum Biosyntéza imunoglobulinů Začalo se osvětlení role jednotlivých subcelulárních frakcí v tomto procesu. Detailní historie problému bylo, že jsme se vztahuje dříve (Sidorov, 1974), takže teď jen stručně o hlavních výsledků zde získaných.
V polovině 60. let imunohistochemicky a elektronové mikroskopie studie ukázaly, že buňky jsou aktivně produkující imunoglobuliny (včetně protilátek) rychle roste endoplasmatického retikula a ribozomy obsahují seskupení (až do 18-25 každý). Přítomnost imunoglobulinů v mikrosomech lymfatických uzlin z imunizovaných zvířat a myelomových buněk bylo také potvrzeno pokusy o přímé tkáně frakcionací (Svvenson, Kern, 1967a).
Nicméně, zvýraznění polyribosomes lymfoidních buněk a prokázat svou schopnost syntetizovat protilátky in vitro v neúspěšném na delší dobu.
Závažným studium mechanismů syntéza imunoglobulinu bylo možné až poté, co byl vyvinut příjem nativní polyribosomes techniky. Hlavní úsilí v tomto případě směřuje ke snížení degradace polyribosomes endogenními RNázou.
V některých případech, uspěl drasticky snížit znečišťování v důsledku extrémně měkkých tkání homogenizačních podmínek, které nezpůsobují destrukci a uvolňování lysozomálních enzymů v homogenátu (Becker, Rich, 1966). Avšak ve většině případů, je působení RNázy snaží zpomalit přidávání inhibitorů. Mezi ně patří cytoplazmatické extrakty z jaterních buněk nebo HeLa, polysulfates a sorbentů - (. Viz Sidorov, 1974) makaloid a bentonit. V posledních letech jako inhibitor RNázy stále více používají heparinu (Schechter, 1974a, b).
optimální dosažené výsledky kombinace měkkých destrukci tkáně podmínek s přídavkem inhibitorů a tak rychle, jak je to možné provedení frakcionační homogenátu při teplotě 0 ° C
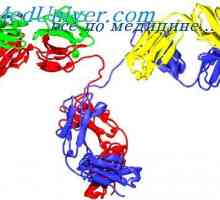 Tříd imunoglobulinů. Struktura imunoglobulinových řetězců
Tříd imunoglobulinů. Struktura imunoglobulinových řetězců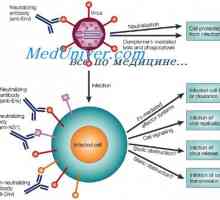 Antigenicita imunoglobulinů. Antigenní determinanty protilátek
Antigenicita imunoglobulinů. Antigenní determinanty protilátek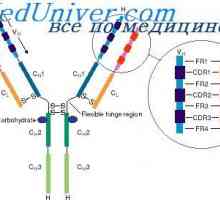 Lokalizace genů světlo řetězce protilátky. Důvody pro proměnlivosti lehkých řetězců
Lokalizace genů světlo řetězce protilátky. Důvody pro proměnlivosti lehkých řetězců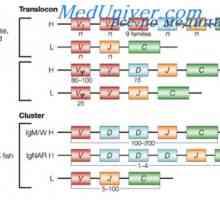 Translokon imunoglobuliny. Kombinace v- a geny protilátek
Translokon imunoglobuliny. Kombinace v- a geny protilátek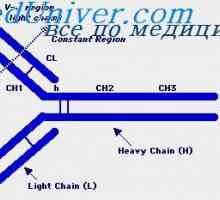 Upevňovací VH geny imunoglobulinu. Chromozom s geny protilátek
Upevňovací VH geny imunoglobulinu. Chromozom s geny protilátek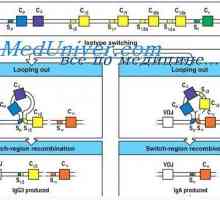 Syntéza imunoglobulinů. tvorba protilátek
Syntéza imunoglobulinů. tvorba protilátek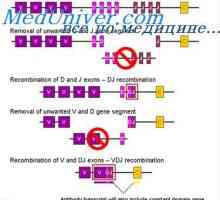 Uspořádání vc-gen. Přepínání protilátkovou aktivitu genu
Uspořádání vc-gen. Přepínání protilátkovou aktivitu genu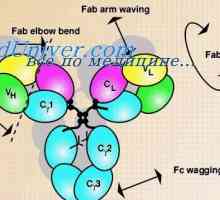 Variabilní oblasti těžkého řetězce. Variabilní oblastních genů těžkých řetězců
Variabilní oblasti těžkého řetězce. Variabilní oblastních genů těžkých řetězců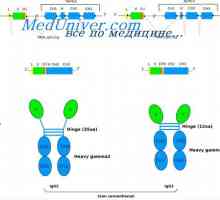 Syntéza Poliribosomny komplex protilátka. RNA podílí na syntéze protilátky
Syntéza Poliribosomny komplex protilátka. RNA podílí na syntéze protilátky Tvorba imunoglobulinových řetězcích. Přebytek protilátky syntéza L-řetězce
Tvorba imunoglobulinových řetězcích. Přebytek protilátky syntéza L-řetězce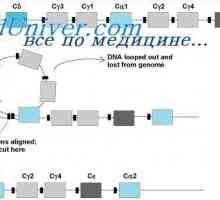 Metody pro izolaci polyribosomes. Rozměry polyribosomes syntetizovat protilátky
Metody pro izolaci polyribosomes. Rozměry polyribosomes syntetizovat protilátky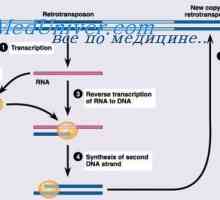 Syntéza imunoglobulinu těžkého a lehkého řetězce. Jednotná syntéza těžkých a lehkých řetězců…
Syntéza imunoglobulinu těžkého a lehkého řetězce. Jednotná syntéza těžkých a lehkých řetězců…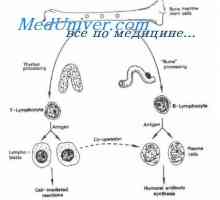 MRNA se podílí na syntéze protilátky. Metody studia mRNA
MRNA se podílí na syntéze protilátky. Metody studia mRNA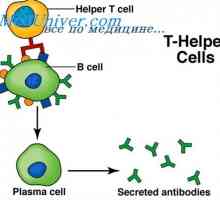 Prekurzory protilátek syntézy L-řetězec. Ekstrapeptidy a jejich funkce
Prekurzory protilátek syntézy L-řetězec. Ekstrapeptidy a jejich funkce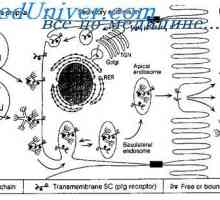 Membránové imunoglobuliny. povrchové protilátky
Membránové imunoglobuliny. povrchové protilátky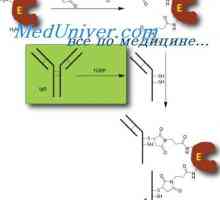 Sestavení protilátky. doplnění imunoglobulinů
Sestavení protilátky. doplnění imunoglobulinů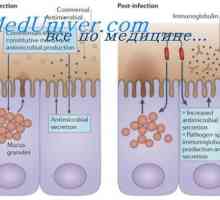 Struktura membránových imunoglobulinů. Původ povrchových protilátek
Struktura membránových imunoglobulinů. Původ povrchových protilátek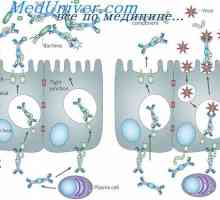 Sekrece imunoglobulinů. Fáze vylučování protilátky
Sekrece imunoglobulinů. Fáze vylučování protilátky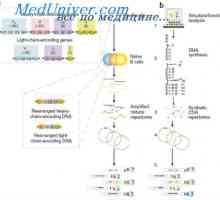 Účinek na fenotyp genové aktivity. Alelické determinanty protilátek
Účinek na fenotyp genové aktivity. Alelické determinanty protilátek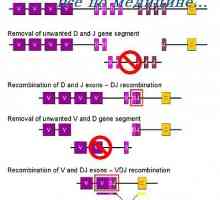 Alelické protilátek štítky. Alelickou exkluzi protilátky
Alelické protilátek štítky. Alelickou exkluzi protilátky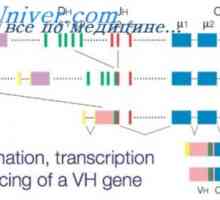 Účinek na fenotyp protilátek těžkého řetězce. Omezení V-geny
Účinek na fenotyp protilátek těžkého řetězce. Omezení V-geny