Metody pro izolaci polyribosomes. Rozměry polyribosomes syntetizovat protilátky
V současné době, zvýrazněte polyribosomes z lymfatické tkáně a myelomu nádory obvykle používat jejich homogenizace v Tris pufru roztocích (pH 7,0 až 7,6), s obsahem sacharózy, KCl (nebo méně - NaCl), MgCl 2 (nebo octanu hořečnatého) a některého z inhibitoru RNázy (častěji - heparin). Předpokladem je použití činidel, které neobsahují žádné RNase. První odstraněn z homogenátu jádra a mitochondrií postmitochondrial supernatant byl přidán do některého z detergentu (deoxycholát sodný nebo Triton X-100) se rozpustí enodoplazmaticheskogo retikula membránu a vysráží polirobosomy (nebo frakcionovaný) v kroku (0,5-1,5 M) nebo lineární (obvykle 15 až 30% roztok), sacharózy gradienty. Výtěžek poliribosomnogo materiál je v tomto případě 30-50% všech buněčných ribozomů.
Stupeň narození polyribosomes, získané z různých zdrojů, vliv na koncentrace sacharózy, iontová síla a pH poměru tlumivého roztoku se používá K / Mg a povahu detergentu. Tak polyribosomes ze sleziny výhodné používat Triton X-100, stejně jako v přítomnosti deoxycholátu sodného vyznačují degradaci. V některých případech se také doporučuje přídavek malých množství SaS12 nebo spermidinu zvyšujících stabilitu buněčných jader (Goryunova et al., 1974- stěnu např. A., 1977), a 2-merkaptoethanolu (Schechter, 1973). V zájmu snížení doby kontaktu polyribosomes z buněčného lyzátu se může také přímo aplikovat na buňky obsahující detergentní inhibitor nalaminovanou přímo na sacharózovém gradientu. V tomto případě, v průběhu odstřeďování kletkp současně lyžovány a frakcionované (Davis např. A., 1969).
Mělo by být poznamenáno, že izolaci nativní polyribosomes buňky z lymfatických tkáních normálních nebo imunizovaného živočišné tkáně je mnohem složitější a méně rozvinuté postup než jejich oddělení od plasmacytomy. Možná, že je to způsobeno tím, že je endogenní inhibitor RNasy plazmocytom, zatímco ve slezině a lymfatických uzlinách, tomu tak není, a RNázová aktivita v imunizaci ještě zvyšuje.

podstatný role, zřejmě hraje druh zvířete. Nejpříznivější objekty, údaje řádek jsou sleziny a lymfatické uzliny z krysy, ze kterých je možné získat nativní polyribosomes, sedimentaci v 250-350S a 160-190S obsahující aktivní pulsu a značku aminokyselin (Vassalli, 1967- Vasil et al., 1969). Existují také zprávy o přidělení nativních polyribosomes ze sleziny králíků (Becker, Rich, 1966- Scharff, Uhr, 1965) a morčat (Nikolaeva, 1976). Vzhledem k tomu, nádorové tkáně nejbohatším zdrojem polyribosomes jsou mielomy- lymfomy v menším počtu těchto organel (Sherr, Uhr, 1971a).
Výsledkem je, že zlepšení frakcionace technika lymfatické tkáně zvířat buňky a myší plasmacytomy podařilo izolovat širokou škálu polyribosomes se sedimentační konstantou od 118s až 350S. Bylo prokázáno, že množství imunizace polyribosomes a půl až dvakrát zvyšuje (Moav, Harris, 1970- YUrin, 1971), a jejich specifické distribuce stává dvoufázovou povahu. Podobné údaje o myelomových buněk byly získány Schubert (Schubert, 1968) a kontakt (Sidorov et al., 1973).
To bylo navrhl, že bifázická distribuce polyribosomes, značené rostoucích polypeptidových řetězců odráží přítomnost dvou tříd polyribosomes zapojených do syntézy H- a L řetězce. Imunoprecipitační experimenty s polyribosomes antiséra H a L řetězce bylo skutečně prokázáno, že H-řetězec detekovány pouze na polyribosomes 270-300S, a L-řetězec - s výhodou na polyribosomes 180-190S (Shapiro ea, 1966a- Askonas Williamson, 1967b ). Podle výpočtů prováděných autory, by měly tyto polyribosomes obsahovat mRNA, která se skládá z přibližně 1250 a 500 nukleotidy, např. E. velmi vhodné pro kódování syntézu H- a L řetězce.
Data získaná Dva zásadně důležité závěry, a to: 1) syntéza imunoglobulinů je monotsistronnyi povaha a 2) velikost polyribosomes a mRNA se podílejí na tvorbě H- a L řetězce, jsou dostatečné pro zakódování syntézy každého z nich jako celku.
 Komplikace prick metodou odběrem krve z paty u novorozenců
Komplikace prick metodou odběrem krve z paty u novorozenců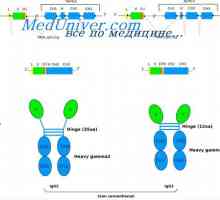 Syntéza Poliribosomny komplex protilátka. RNA podílí na syntéze protilátky
Syntéza Poliribosomny komplex protilátka. RNA podílí na syntéze protilátky Tvorba imunoglobulinových řetězcích. Přebytek protilátky syntéza L-řetězce
Tvorba imunoglobulinových řetězcích. Přebytek protilátky syntéza L-řetězce Syntéza imunoglobulinu těžkého a lehkého řetězce. Jednotná syntéza těžkých a lehkých řetězců…
Syntéza imunoglobulinu těžkého a lehkého řetězce. Jednotná syntéza těžkých a lehkých řetězců… MRNA se podílí na syntéze protilátky. Metody studia mRNA
MRNA se podílí na syntéze protilátky. Metody studia mRNA Plazmové myší nádory. role Polyribosomes v biosyntéze imunoglobulinů
Plazmové myší nádory. role Polyribosomes v biosyntéze imunoglobulinů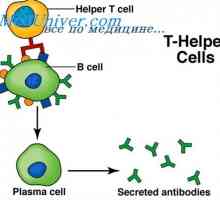 Prekurzory protilátek syntézy L-řetězec. Ekstrapeptidy a jejich funkce
Prekurzory protilátek syntézy L-řetězec. Ekstrapeptidy a jejich funkce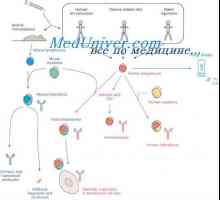 Hybridizace mRNA a DNA protilátek. Lokalizace v- a geny v genomu imunoglobulinů
Hybridizace mRNA a DNA protilátek. Lokalizace v- a geny v genomu imunoglobulinů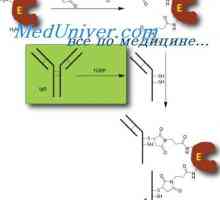 Sestavení protilátky. doplnění imunoglobulinů
Sestavení protilátky. doplnění imunoglobulinů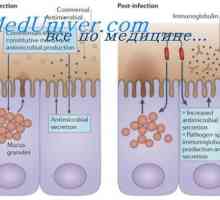 Struktura membránových imunoglobulinů. Původ povrchových protilátek
Struktura membránových imunoglobulinů. Původ povrchových protilátek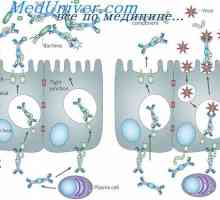 Sekrece imunoglobulinů. Fáze vylučování protilátky
Sekrece imunoglobulinů. Fáze vylučování protilátky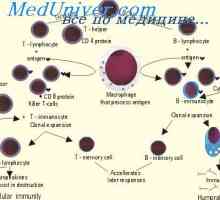 Tvorba T buněk v brzlíku. Pohybující se v brzlíku lymfocyty předchůdce
Tvorba T buněk v brzlíku. Pohybující se v brzlíku lymfocyty předchůdce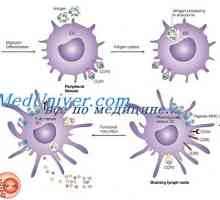 Vliv imunomodulátor na dendritických buňkách. Morfologie dendritických buněk
Vliv imunomodulátor na dendritických buňkách. Morfologie dendritických buněk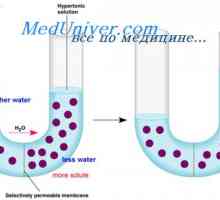 Regulace výměny tekutin. Osmóza a osmotický tlak
Regulace výměny tekutin. Osmóza a osmotický tlak Meruňky s pankreatitida
Meruňky s pankreatitida Fruktóza zánět slinivky břišní, je to možné?
Fruktóza zánět slinivky břišní, je to možné? Cukr a slinivky břišní, pankreatitida náhradou
Cukr a slinivky břišní, pankreatitida náhradou Léčba hypoxické syndromu plodu během porodu
Léčba hypoxické syndromu plodu během porodu Malabsorpční syndrom z poruchou střevní absorpce. Klinický symptom způsobené vstřebáváním přes…
Malabsorpční syndrom z poruchou střevní absorpce. Klinický symptom způsobené vstřebáváním přes… TIENAM (TIENAM) (název společnosti droga "Merck & k., Inc.", Rahway n
TIENAM (TIENAM) (název společnosti droga "Merck & k., Inc.", Rahway n Vrtný výplach (louh vurovi). 8% roztok octan hlinitý (louh aluminii subacetatis 8%). Synonyma…
Vrtný výplach (louh vurovi). 8% roztok octan hlinitý (louh aluminii subacetatis 8%). Synonyma…