Členění ubikvitin-proteosomové cesty protein
Most (80-90%) intracelulární odbourávání bílkovin provádí ubikvitin-proteosomové cesty. Ubiquitní-proteazomu dráha je přítomno v jádru a cytoplazmě eukaryotických buněk a hraje důležitou roli v rozdělení normální a abnormální proteinů. Tato dráha je zodpovědný za řízenou degradaci mnoha proteinů, včetně těch, potřebné k řízení růstu a proliferaci buněk, diferenciaci buněk, imunitních a zánětlivých reakcí, apoptózu a metabolické adaptace.
Ubiquitní-proteazomu dráha rovněž vykonává funkci „ekonomickou“ hlavně cirkulace proteinu a odstranění abnormální proteiny se špatnou kódování, špatně složeného lokalizované v non-klíčových oblastech, poškozené nebo jinak vyřazeno z činnosti. Ubiquitní-proteazomu systém hraje důležitou roli při kontrole svalové hmoty a její aktivita je zvýšena v kachexii. Tato dráha také hraje významnou roli při obnově svalů a předělávání.
Ubiquitní-proteazomu dráha To může být nahlíženo jako sled tří procesů:
(1) uznání proteinového substrátu na rozpad;
(2) kovalentní připojení polyubiquitinového řetězce jako protein tag pro rozpad;
(3) proteolýza 2500 kDa proteinový komplex, nazvaný 26S proteazom.
rozpoznávání protein, určen k rozkladu typicky se provádí:
(1) podle některých strukturálních změn proteinu, včetně účinků na sekvenci specifické aminokyseliny, která je skryta v normálních posttranslačních modifikací, jako je fosforylace, nebo hydroxylace;
(2) pro spojení nebo uvolnění jeho ligandů;
(3) interakce s adaptérem proteinem nebo chaperon (např., Export špatně sbalených proteinů od chaperonů v cytosolu EPR);
(4) Specifická poškození vyskytující se v proteinu, oxidací nebo nitrosylace.
Kromě toho, přítomnost specifických "destabilizující„Zbytky iV-koncová část známky peptidu určeného pro štěpení (tj, s krátkým poločasem). Mělo by však být poznamenáno, že předtím, než byl podroben štěpení, ne všechny proteiny produkovány ubikvitinu tag.
Naproti tomu některé proteiny štěpení 20S major proteazomu. Účelem tohoto modelu je nejasné rozdělení, ale zdá se, že se děje s proteiny, které mají zjevně nestrukturovaná regiony, což proteinu větší nestabilitu.

První reakce - aktivace E1 ubikvitinu (ubikvitinaktiviruyuschim enzym) a pak doručena ubikvitin E2 (ubikvitinprisoedinya yuschemu-enzymu).
Druhá reakce - tvorba komplexu s E2, EZ (ubiquitin spojující enzymu) a substrátem.
Třetí reakce - přenos ubikvitinu lysin (-am) substrátu, přičemž substrát označit polyubiquitinový řetězce. Jako výsledek, čtvrtý krok se oddělí od substrátu polyubiquitinového E3.
A konečně, proteazom substrát odvíjela ATP-dependentní způsobem činnosti ubikvitingidralazy odděluje ubiquitin řetězce a vloží rozloženého proteinu v proteazomu komory jsou části, kde aktivita proteázy. Molekuly ubikvitin je recyklován, přičemž výsledné peptidy jsou členěny na aminokyseliny a znovu použít pro syntézu nového proteinu.
Ub - ubikvitin.
Poté, co byl identifikován jako protein substrát na degradaci, je opatřen kovalentně značené ubikvitinu. Ubikvitin - protein přítomný ve všech typech buněk a sestává z 76 aminokyselinových zbytků, včetně glycinu C-terminální a lysinový zbytek v poloze 48. ubiquitin je kovalentně vázán na protein určený pro degradaci v sérii tří reakcí katalyzovanou enzymů známých jako E1 (ubikvitinaktiviruyuschy enzym), E2 (ubikvitinprisoedinyayuschy enzym) a E3 (ubikvitinsvyazyvayuschy enzym).
tam Dvě isoformy E1, Několik isoformy E2 a E3 je velmi velké množství enzymů, což umožňuje pro konkrétní substráty mnoha tkání a regulaci tohoto procesu.
první molekula ubikvitin aktivována navázáním na E1 ATP-dependentní reakce, a pak se převede na ubikvitin E2 fragment. A E1 a E2 jsou aktivní místa cysteinových zbytků, které tvoří thioestery se zbytek glycinu na C-terminální ubikvitinu. A konečně, ubiquitin připojen k E2 je přenášen přímo, nebo přes vnitřní E3 lizilovomu zbytku na proteinovém substrátu.
E3 hraje důležitou roli při rozpoznávání proteinový substrát pro štěpení a v regulaci formování substrátu komplexní E2 / E3. Podobným způsobem se dále ubiquitin molekuly připojené k substrátu, který má jeden připojený ubikvitinu molekulu, tvořící isopeptidové vazby mezi zbytek glycinu v C-terminální ubiquitin molekulou a lysin se nachází v poloze 48 před přidaného ubiquitin molekuly.
potřebný řetěz alespoň čtyři molekuly ubikvitinu na proteiny několik molekul označených ubiquitin byly snadno rozpoznatelné a směřují k 26S proteazomu, štěpení. V poslední době, průzkum se vazebné domény pro činnosti a ubikvitinu. Důležité je, že proces je reverzibilní ubikvitinace, s přítomností odpojení procesu, který se vyskytuje třídu cysteinových proteáz nazývaných deubikvitiniruyuschimi enzymy.
aktivita deubikvitiniruyuschego enzym Je zcela eliminují vazbu na ubikvitinu, ubikvitin zpracování prekursoru, spojující ubiquitin řetězy a opětovné ubiquitin. Tyto procesy jsou odpovědné za regulaci několika signálních drah, které jsou důležité pro proces vývoje, včetně růstu a diferenciace buněk.
skutečný degradace ubikvitinované proteiny dochází ve vnitřním prostoru proteazomu, ale molekuly ubikvitin odštěpí jako první, takže mohou být znovu použity, 26S proteazom je velký, skládající se z několika podjednotek komplexu, který zahrnuje podjednotky 20S jako proteolytické jádro s regulačními 19S komplexními připojených k jedné nebo obou koncích. Regulační podjednotky se účastní rozpoznávání značených proteinů, ubikvitin odstranění tag, jakož i ATP-dependentní procesy odvíjející se z proteinu a jeho proteolytickou jádra ve směru, který má tvar tunelu.
proteolytický 20S komplex je barelovitý strukturu skládající se ze čtyř naskládaných na sebe prstencových struktur (ABBA), z nichž každá je tvořena sedmi podjednotek. Centrální dutina katalytické struktury obsahuje celkem šest proteolytických částí vytvořeny tři různé katalytické podjednotky každé B-kruhu. Ty se týkají katalytické podjednotky TV-terminální threonin gidralazam jako iV-terminální threonin působí jako nukleofilního katalyzátoru. Nicméně, tři různé podjednotky v každém ze dvou kruhů jsou různé nastavení v štěpení peptidové vazby ihned po základní, hydrofobních a zbytků.
20S podjednotku hydrolyzují příchozí substrátu do peptidové fragmenty se skládají z 3-30 aminokyselinových zbytků. Tyto peptidové produkty jsou uvolněny z proteazomu v buňce a pak podstoupí hydrolýzy dalších proteáz a aminopeptidáz.
předpis proteolýza v proteazomu dochází na třech úrovních. Za prvé, uznání substrátu je nastavitelná funkce, které stanovené pro cílového proteinu poliubikvitinirovaniya. Pro většinu proteinů jsou neidentifikovaných substráty a zahrnují fosforylaci, hydroxylaci zbytku prolinu nebo identifikační štěpení signálu obsažené v primární sekvenci. Za druhé, regulované degradace konkrétních druhů substrátů může být dosaženo kombinací komplexů E2 / EZ se různé vedlejší faktory.
Například, v některých případech, a to EZ Je třeba měnit nebo „zapnuto“ prostřednictvím post-translační modifikace, aby se jeho aktivní formu, která rozpoznává substrát. V jiných případech, stabilita proteinu substrátu závisí na jeho vztahu s molekulárními chaperony, které působí jako detekčními prvky a které slouží jako spojení s příslušnými ligázy. Zejména inzulín snižuje aktivitu ubikvitinu-proteazomu zprostředkované intracelulárními proteázami a pohybu insulinosnizhayuschego enzymu 20S proteazomu a 26S. Konečně, ubiquitin-proteasomu cesta může být řízena buď interakcí nebo změny v expresi ubikvitinu proteazomu podjednotek.
Příkladem toho může být pozorován po Intravenózní infuze aminokyselin nebo po jejich zavedení do lumen střeva. Zvýšená dodávku aminokyselin, ale ne glukóza snižuje expresi mRNA ubikvitinu ubikvitinprisoedinyayuschego enzymu s molekulovou hmotností 14 kDa, a C9 podjednotky proteazomu ve střevní sliznici.
 Protein ncx1 proti srdečním selháním
Protein ncx1 proti srdečním selháním Methylenová modř může být lék na Alzheimerovu chorobu
Methylenová modř může být lék na Alzheimerovu chorobu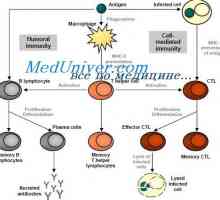 Signály Toll-like receptory. Úloha molekuly MyD88
Signály Toll-like receptory. Úloha molekuly MyD88 Účinek růstového hormonu (GH), v žaludku. Hodnota nadledvin ACTH
Účinek růstového hormonu (GH), v žaludku. Hodnota nadledvin ACTH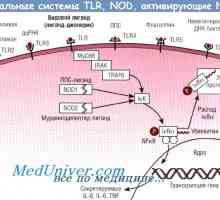 Vliv střevních bakterií na jeho zánětlivé odpovědi
Vliv střevních bakterií na jeho zánětlivé odpovědi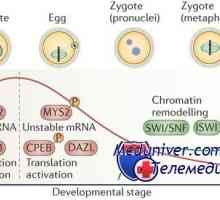 Mateřské efekt geny. Kódování proteiny oocytu
Mateřské efekt geny. Kódování proteiny oocytu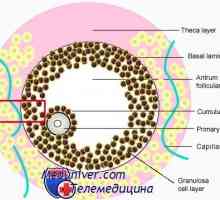 Známky připravenost oocytů meiózy. Rozpouštění zárodečného váčku (m)
Známky připravenost oocytů meiózy. Rozpouštění zárodečného váčku (m) Mechanismy rozpad a katabolismus proteinů v organismu
Mechanismy rozpad a katabolismus proteinů v organismu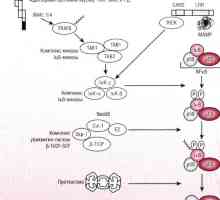 Patogeneze způsob NFKB / rel v reakci na bakterie střevního epitelu
Patogeneze způsob NFKB / rel v reakci na bakterie střevního epitelu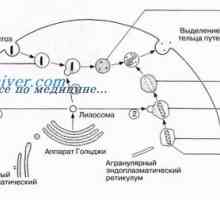 Autofagalno-lysozomální systém štěpení proteinů apoptóza
Autofagalno-lysozomální systém štěpení proteinů apoptóza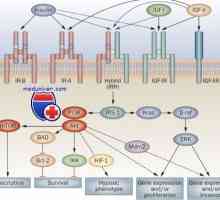 Receptorů s tyrosin kinázy. Receptory pro inzulín a růstové faktory
Receptorů s tyrosin kinázy. Receptory pro inzulín a růstové faktory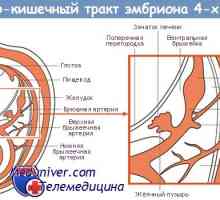 Genetická regulace tvorby střevní trubice
Genetická regulace tvorby střevní trubice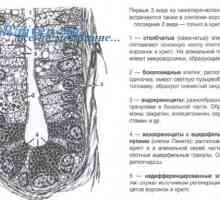 Význam Wnt signalizace v regulaci střevních kmenových buněk
Význam Wnt signalizace v regulaci střevních kmenových buněk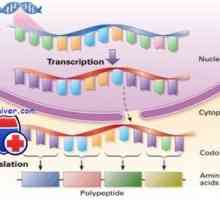 Regulace transkripce a translace v oocytu
Regulace transkripce a translace v oocytu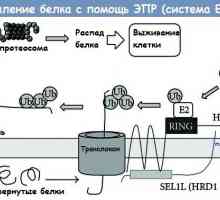 Štěpení proteinu prostřednictvím endoplazmatického retikula (ER) ERAD systému
Štěpení proteinu prostřednictvím endoplazmatického retikula (ER) ERAD systému Jednoduchý krevní test může ukázat účinnost léčby rakoviny
Jednoduchý krevní test může ukázat účinnost léčby rakoviny Vytvořilo slibný lék na rakovinu ledvin
Vytvořilo slibný lék na rakovinu ledvin Nová strategie pro boj proti sepsi
Nová strategie pro boj proti sepsi Antioxidant brokolice lze léčit Progeria?
Antioxidant brokolice lze léčit Progeria? Ve Spojených státech schválil zařízení pro fetální testu bez stresu doma
Ve Spojených státech schválil zařízení pro fetální testu bez stresu doma Nedostatek zinku a naše trápení
Nedostatek zinku a naše trápení