Stabilizace imunoglobulinů hapteny. Závislost konformace protilátky teploty
Existují údaje z různých metody, směřující ke zvýšení stability protilátky a jejich Fab fragmentů vyplývající z komplexaci s hapteny. Například přídavek nich zvyšuje stabilitu hapten molekul denatiruyuschemu působení guanidin hydrochloridu (Cathou, Werner, 1970) a pro působení chymotrypsinu (Grossberg např. A., 1965).
IgM protilátky také stabilizovat specifické hapteny s ohledem na proteolýzou subtilisinu a chymotrypsinu (Ashman, Metzger, 1971). Bylo prokázáno, že snížení citlivosti k útoku proteázami IgM zcela z důvodu změny vlastností Fab fragmentů. Podle našeho modelu, se posune rovnováha hapten komponent A a B Fab-fragment vlevo.
Proto, aby vysvětlil citované stačí, aby uvedené výsledky, že volná energie je kompaktnější konformer Spodní volná energie konformeru B (t. j. A-konformer stabilnější než B). Pokud ano, pak ke zvýšení stability proteinů, nezávisí na tom, jak se odpovídající rovnováha posun způsobil.
Ve skutečnosti se ukázalo, že posun Rovnováha doleva spin-značené dimery lehkých řetězců, simulující strukturu Fab-podjednotek působením 1,2 M NaCl a 0,75 M (NH 4) AS04 zvyšuje jejich stabilitu v závislosti na teplotě. Podobný posun v rovnováze mezi A a B konformerů způsobuje další rozrušující strukturu proteinu a jeho hydratace shell činidla, jako je dodecylsulfát sodný a teploty.

závislost konformační stav IgG detekovaná jinými metodami teploty. Například, G. Troitskii a spolupracovníci (1971) a J. F. Kiryuhin a spolupracovníci (1972) od optické rotační disperze pozorovány reverzibilní změny konformace přechodovou teplotu závislých na pH, od 27 ° do 38 °. Následně se ukázalo, že v neutrální oblasti pH přechodové teploty nezávisí na isoelektrický bod IgG.
Nicméně, když pH, vzdálený od izoelektrického bodu, když je molekula IgG stane dostatečně velký vlastní náboj, teplota konformační přechody jsou zcela chybí (Troitsky e. a., 1973). V VP Zavyalova a personál (Zavyalov např. A., 1975) provedla mnohostranné výzkum myelom konformace proteinu v závislosti na pH a teploty od optické rotační disperze, cirkulární dichroismus spektroskopie znepokojující, elektrochemické jodace a diferenční skenovací kalorimetrie.
Bylo zjištěno, že když pH se změnilo z 6,0 na 6,5 dostupnost chromoforní skupiny rozpouštědel snižuje. To může mít v důsledku změn počtu nabitých skupin v proteinu a snižuje intermolekulární elektrostatické síly odporu. Podobný jev - stínící část tyrosin a tryptofan zbytky (pH 7,35- 0,01 M fosfátového pufru) -nablyudali se zvyšující se teplotou od 25 do 35 ° C. K tomu dochází po navázání na hapten dinitrofenyl homologní králičí protilátky (IgG).
Tyto výsledky lze považovat za údaj o tom, že oteplení a formování specifických komplexů s hapteny zvyšuje kompaktnost, který je v souladu s celou řadou prací citovaných výše.
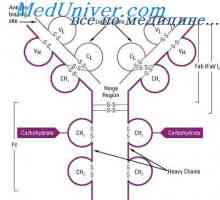 Struktura aktivních center protilátek. Studium aktivních míst imunoglobulinů
Struktura aktivních center protilátek. Studium aktivních míst imunoglobulinů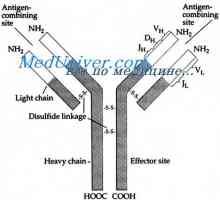 Imunoglobulin centrum g. Aktivní IgG Center
Imunoglobulin centrum g. Aktivní IgG Center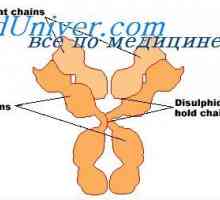 Vlastnosti protilátek aktivních center. reaktivita imunoglobulinů
Vlastnosti protilátek aktivních center. reaktivita imunoglobulinů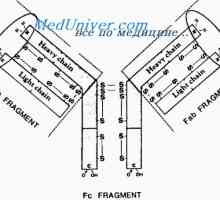 Imunoglobulin reaktivita. Metoda spin značeného hapteny
Imunoglobulin reaktivita. Metoda spin značeného hapteny Flexibilita imunoglobulin G a e. Flexibilita typů imunoglobulinů
Flexibilita imunoglobulin G a e. Flexibilita typů imunoglobulinů Polarizace metody fluorescenční protilátky. Korelace imunoglobulinu
Polarizace metody fluorescenční protilátky. Korelace imunoglobulinu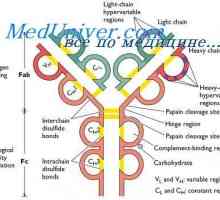 Změny v protilátkových molekul. Konformace imunoglobulinu
Změny v protilátkových molekul. Konformace imunoglobulinu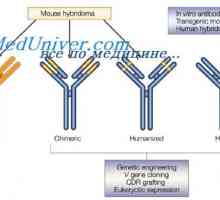 Modifikace protilátky po reakci s antigenem. komplementu center
Modifikace protilátky po reakci s antigenem. komplementu center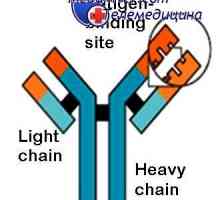 Sdružení imunitních komplexů. Mechanismy pro disociaci protilátky-antigenu
Sdružení imunitních komplexů. Mechanismy pro disociaci protilátky-antigenu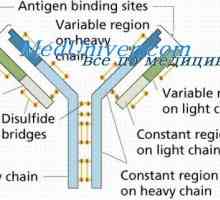 Sraženina imunitní komplexy. Interakce domény řetězce protilátky
Sraženina imunitní komplexy. Interakce domény řetězce protilátky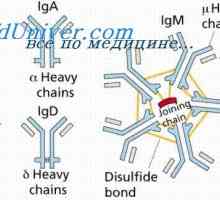 Konformennaya model imunitních komplexů. Interakce protilátek s antigeny
Konformennaya model imunitních komplexů. Interakce protilátek s antigeny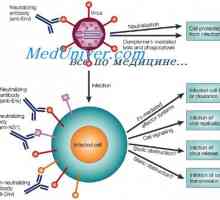 Antigenicita imunoglobulinů. Antigenní determinanty protilátek
Antigenicita imunoglobulinů. Antigenní determinanty protilátek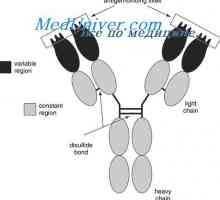 Tvorba těžkého řetězce imunoglobulinu. Konstantní oblast těžkého řetězce protilátky
Tvorba těžkého řetězce imunoglobulinu. Konstantní oblast těžkého řetězce protilátky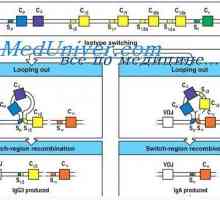 Syntéza imunoglobulinů. tvorba protilátek
Syntéza imunoglobulinů. tvorba protilátek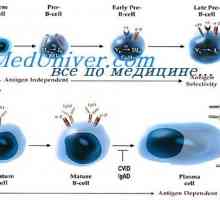 Trvání mRNA protilátky. Vliv na syntézu mRNA imunoglobulinu
Trvání mRNA protilátky. Vliv na syntézu mRNA imunoglobulinu Počáteční populace lymfatických buněk. Mozaika buněk protilátek tvořících
Počáteční populace lymfatických buněk. Mozaika buněk protilátek tvořících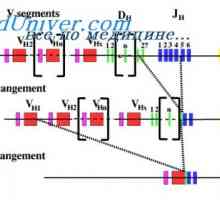 Drsné potlačení V-geny. Multipotenciální buňky syntetizují protilátky
Drsné potlačení V-geny. Multipotenciální buňky syntetizují protilátky Hypotéza dva signály. Schéma interakce T a B lymfocytů
Hypotéza dva signály. Schéma interakce T a B lymfocytů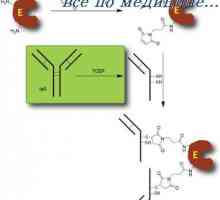 Aktivace Model v buňkách. indukce protilátek
Aktivace Model v buňkách. indukce protilátek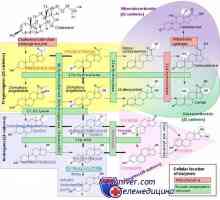 Diagnóza steroidních hormonů. metody
Diagnóza steroidních hormonů. metody Agranulotsitozumenshenie leukocytů. (Méně než 1000 v 1 l), nebo počet granulocytů (méně než 750 na…
Agranulotsitozumenshenie leukocytů. (Méně než 1000 v 1 l), nebo počet granulocytů (méně než 750 na…