Modifikace protilátky po reakci s antigenem. komplementu center
Podobné výsledky byly získány s použitím stejné Způsob antipolisaharidnymi protilátky. Jako antigeny používané oligosacharidy rostoucí délkou, včetně tetra-, hexa- a oktasacharidů a 16-členným oligomeru. Stejně jako ve výše uvedených pokusech, po interakci s antigenem byly pozorovány změny v spektrech, ačkoli použití izolované nebo Fab F (ab) 2 fragmenty, tyto změny byly méně výrazné.
Tyto experimenty také naznačují, existence interakce mezi FAB- a Fc částí IgG molekul a odpovídající změny v její část vázající Fc-antigenu po tom, že je dostatečně velká pro vyplnění dutiny aktivního centra. Přidáním malé velikosti hapten konformační změny lze nalézt.
Velký zájem v souvislosti s touto otázka Přítomnost protilátek konformační změny způsobí, že dílo, které ukazují na možnost spolupráce změn alosterické mezi podjednotkami molekul protilátek po navázání antigenu.
Jedna série experimentů, vyrobené v laboratoři Koshlenda (Brown, Koshland, 1975), na základě studie schopnosti Fc-fragment fixovat komplement vazbou protilátky na antigen. V těchto experimentech, použití IgM protilátek proti beta-laktosidy. Sama o sobě tato hapten neindukoval aktivitu komplementu upevnění. Teprve po spojení nespecifický nosný protein (RNase jeden hapten mol) se získal schopnost vyvolat tuto činnost.
Vzhledem k tomu, antigen je jednomocný, nemohl zjistit agregace nebo zesítění molekul protilátek IgM, které jsou známy, může dojít k aktivaci systému komplementu. Další vysvětlení, a to, že provoz některých částí Fc fragmentů závisí na konformační změny v důsledku vázající antigen v aktivním místě, je pravděpodobnější.
Toto vysvětlení se předpokládá, že alosterické vlastnosti imunoglobulinů.

Ve studii komplementaktiviruyuschey Schopnost třídy IgG protilátky bylo zjištěno, že nemůže být vyvolána konformačních změn FAB a Fc-podjednotek, které jsou založeny na údajích CPP doprovázejí vazby monovalentní antigen. Nicméně reakce protilátka divalentní s antigenem (dimer lysozymu smyčka peptid) připojené schopnost aktivovat komplement protilátky.
V tomto případě, zejména uvedl pokusy na analytické ultracentrifugy ukázalo, že tento imunitní odpověď, stejně jako v experimentech s monovalentní antigen není doprovázena tvorbou agregátů. Autoři se domnívají, že bivalentní antigen schopnosti tvořit určité úhlové vztahy mezi FAB a Fc fragmentů, ve kterém je možné expozici komplementu sekcí.
Další experimenty zkoumal Schopnost králičích protilátek Třída IgG vázat komplement, po reakci s antigeny, v závislosti na velikosti antigenů. Protilátky připravené v králících imunizací pneumokokových polysacharidů. Antigeny byly stanoveny oligosacharidy izolovány od zdroje polysacharidu podle jeho zvláštní zpracování. V tomto systému, na komplementu stanovení aktivity imunitních komplexů se projevuje pouze tehdy, když je velikost cukru oligomeru zvýšena na 21 nebo více zbytků cukrů.
analýza sedimentace Ukázalo se, že agregáty vytvořené antigen - protilátka, v tomto případě obsahují čtyři nebo více molekul protilátek (Jaton e a, 1976..). V těchto jednotkách úhly mezi rozsahu Fab-subedinitsamiIgG od 90 ° do 180 °, zatímco v komplexy nejsou aktivní, pokud jde o doplněk úhlu mezi Fab fragmentů byl menší než 60 °.
Tím, kruhové polarizace paralelně fluorescence korelace byla nalezena mezi velikostí oligosacharidových haptenů a rozsahu konformační změny v Fc.
Můžeme tedy konstatovat, že aktivace míst komplement stanovení IgG Vyskytuje se kombinací antigenem indukované konformační změny podjednotky IgG a zvětšením úhlu mezi Fab fragmentů o více než 90 °. Je možné, že v druhém stavu, IgM již existuje vázat se na antigen, takže agregace těchto molekul není nutné.
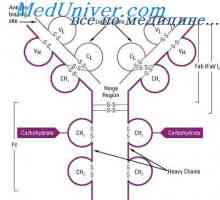 Struktura aktivních center protilátek. Studium aktivních míst imunoglobulinů
Struktura aktivních center protilátek. Studium aktivních míst imunoglobulinů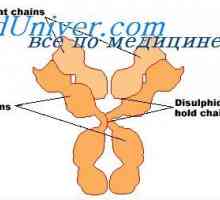 Vlastnosti protilátek aktivních center. reaktivita imunoglobulinů
Vlastnosti protilátek aktivních center. reaktivita imunoglobulinů Flexibilita imunoglobulin G a e. Flexibilita typů imunoglobulinů
Flexibilita imunoglobulin G a e. Flexibilita typů imunoglobulinů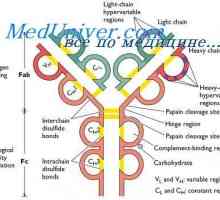 Změny v protilátkových molekul. Konformace imunoglobulinu
Změny v protilátkových molekul. Konformace imunoglobulinu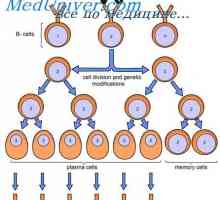 Stabilizace imunoglobulinů hapteny. Závislost konformace protilátky teploty
Stabilizace imunoglobulinů hapteny. Závislost konformace protilátky teploty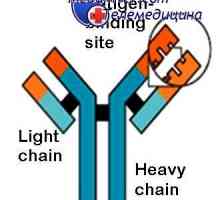 Sdružení imunitních komplexů. Mechanismy pro disociaci protilátky-antigenu
Sdružení imunitních komplexů. Mechanismy pro disociaci protilátky-antigenu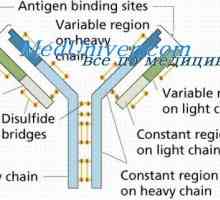 Sraženina imunitní komplexy. Interakce domény řetězce protilátky
Sraženina imunitní komplexy. Interakce domény řetězce protilátky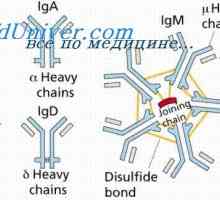 Konformennaya model imunitních komplexů. Interakce protilátek s antigeny
Konformennaya model imunitních komplexů. Interakce protilátek s antigeny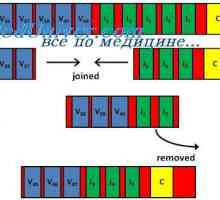 Výchozí protilátky buněk. cell Predeterminirovannost
Výchozí protilátky buněk. cell Predeterminirovannost Inhibice tvorby protilátek. Syntéza protilátky zpětné vazby
Inhibice tvorby protilátek. Syntéza protilátky zpětné vazby Buňka Spolupráce humorální imunita. Zahájení humorální odpovědi
Buňka Spolupráce humorální imunita. Zahájení humorální odpovědi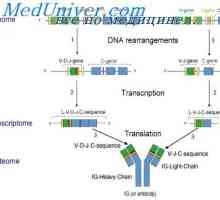 Protilátková odpověď. Role makrofágů v indukci protilátky
Protilátková odpověď. Role makrofágů v indukci protilátky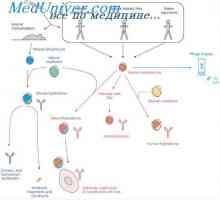 Interakce T a B lymfocytů. Interakce lymfocytů a makrofágů
Interakce T a B lymfocytů. Interakce lymfocytů a makrofágů Hypotéza dva signály. Schéma interakce T a B lymfocytů
Hypotéza dva signály. Schéma interakce T a B lymfocytů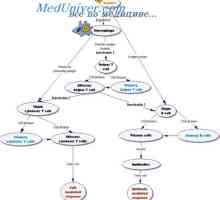 Indukce imunitní odpovědi. Regulace imunitní odpovědi
Indukce imunitní odpovědi. Regulace imunitní odpovědi Proliferaci B lymfocytů. Diferenciace do buněk
Proliferaci B lymfocytů. Diferenciace do buněk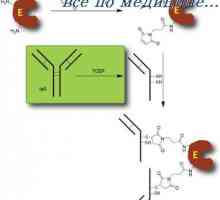 Aktivace Model v buňkách. indukce protilátek
Aktivace Model v buňkách. indukce protilátek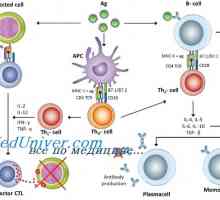 Mechanismy primární imunitní odpovědi u plodu
Mechanismy primární imunitní odpovědi u plodu Funkce v buňkách. Typy molekul na povrchu lymfocytů.
Funkce v buňkách. Typy molekul na povrchu lymfocytů.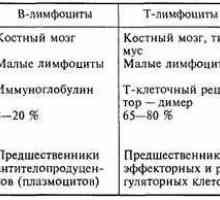 Původ (tvorba), buněk imunitního systému. Funkce buněk imunitního systému. Lymfopoéze. Bursa z…
Původ (tvorba), buněk imunitního systému. Funkce buněk imunitního systému. Lymfopoéze. Bursa z…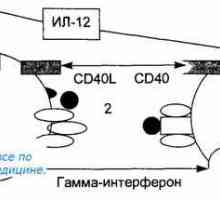 Antigen prezentace. antigen uznání. Interakce T-helper (Th1) s antigen prezentujících buněk.
Antigen prezentace. antigen uznání. Interakce T-helper (Th1) s antigen prezentujících buněk.