Onkologiya-
DA Nosov
Cancer Russian Research Center. NN RAMS, Moskva
zdroj RosOncoWeb.Ru
V současné době je velké množství základního výzkumu sfokusirovanona hledání nových udržitelné přístupy k protinádorové terapii.Ponimanie molekulárních mechanismů zodpovědných za mitogenní aktivnosttransformirovannyh buněk otevírá nové možnosti opuholevogorosta kontrolu. Jeden z objektů aktivně studovaných v posledních letech kachestvenovoy cíl protinádorové je epidermalnogofaktora růstu (EGFR).EGFR - transmembránový glykoprotein o molekulové hmotnosti 170 kDa, které mají tyrosin kinasovou aktivitu. EGFR (HER1 nebo) otnositsyak rodiny epidermálního růstového faktoru receptoru, které takzhepredstavleno své další druhy: erbB2 / erbB3 / HER3 ierbB4 / HER4 HER2 neutralizace.
EGFR je exprimován na povrchu normálních i transformirovannyhepitelialnyh buněk, a je zapojen do regulace buněčné diferenciace Rostand. Jako všechny receptorových tyrosinkináz, EGFR sostoitiz tří sekcí: extracelulární doménu vázající ligand, transmembrannyygidrofobny místě a intracelulární domény tyrosinkinázy (Obrázek 1).

Obr. 1. Schéma struktury EGFR.
V roli ligandů jednají vylučuje normální a / nebo růstu opuholevymikletkami faktory EGF a TGF-a, jsou autokrinní a / iliparakrinnym o regulaci aktivity receptoru růstového epidermalnogofaktora. Aktivace EGFR odnogoiz dochází po navázání specifických ligandů k extracelulární doméně, posledovatelnyhkonformatsionnyh změny dimerizace receptoru a tyrosinových zbytků intracelulární reaktsiifosforilirovaniya domena.Na fázi interakce s růstovými faktory existuje pouze vozmozhnostne EGFR homodimerizaci, tj tvoří dvě identichnyhretseptorov EGFR ligandu spojeného s běžnou, ale může se objevit heterodimerizaci s ostatními členy rodiny EGFR, erbB, zejména receptoru Her2 / neu a erB3. Vzdělávání geterodimeraprivodit k výraznému zvýšení intracelulárního signalizačního impulsov.V důsledku všech těchto interakcí aktivovaných tirozinkinazacherez speciální proteiny spouští kaskádu vnutrikletochnyhprotsessov vysílací impuls do buněčného jádra a tím initsiiruetkletochnuyu proliferaci a mnoho dalších biologických účinků otvetstvennyhza progrese nádoru: adheze a invaze transformirovannyhkletok, zahrnutí antiapoptotických mechanismu (1). Kromě toho, TGF-a a EGF mohou indukovat nádorově procesy angiogenezaza účet nadměrná exprese vaskulárního endoteliálního růstového faktoru (VEGF) (1,2).
Tak můžeme rozlišit tyto hlavních mechanismů aktivatsiiEGFR závislé signálních drah v rakovinných buněk: 1) giperekspressiyaEGFR, 2) přebytek produkce růstových faktorů (TGF-a, EGF), 3), EGFR mutace a v důsledku toho jeho zlepšené aktivnostpri absence faktorů růst, 4) receptor heterodimerizaci.
Když množství epitelových nádorů (rakovina plic, vaječníků, tlustého střeva, prostaty, spinocelulární karcinom krku golovyi) zjištěna zvýšená exprese EGFR a / nebo jeho ligandy odnogoiz (EGF TGF-a), což může způsobit povyshennoyproliferativnoy aktivitu transformovaných buněk (3 4). nádorové buňky GiperekspressiyaEGFR, obvykle spojené s pozdnimistadiyami a metastatického fenotypu onemocnění a, v uvedeném pořadí, koreluje se špatnou prognózou (5).
Tabulka 1.
Exprese EGFR různých typů nádorů.
| typ nádoru | EGFR exprese Frequency |
|---|---|
| Nemalobuněčný karcinom plic | 40% -80% |
| Rakovina tlustého střeva | 25% -77% |
| rakovina žaludku | 33% |
| rakovina vaječníku | 35% až 70% |
| rakoviny prsní | 15% až 30% |
| rakovina prostaty | 40% |
Existuje několik možností blokování implementována cherezEGFR biologického účinku:
1) Použití monoklonální protilátky nebo vazebné ekstratsellyulyarnyyuchastok receptoru, které je neaktivní komplex s EGF a TGF-a-2) Aplikace rekombinantních peptidových ligandů EGF a / nebo TGF-a, s místem proniká do buňky tsitotoksinami- 3) za použití nízkomolekulárních inhibitorů, která je schopna vozdeystvovatna intracelulární doména EGFR a přerušit proces tirozinkinaznogofosforilirovaniya (ZD 1839- OSI-774).
Za posledních 15 let, všechny tyto přístupy značně razrabatyvayutsyav experiment s cílem nalézt nové potenciální protivoopuholevyhagentov a jejich zavedení do klinické praxe. etogopoiska Výsledkem byla syntéza léčiv, jako je například cetuximabu (C225), Iressa (ZD1839) a OSI-774, která byla aktivně studoval u fáze II a III klinických studií.
Cetuximab (C225) je chimérická rekombinanty monoklonalnoeantitelo, který má vysokou specificitu pro extracelulární domenuEGFR, a tedy schopná kompetovat s estestvennymiligandami (EGF TGF-a) pro vazbu na receptor. Léčivo je syntetizován na myší monoklonální protilátky M225, který se kondenzuje dlyasnizheniya imunogenity fragmentu lidského IgG1.
Výsledky klinických studií provedených v rámci fáze I předložené v roce 2000 na ASCO, vypadají slibně (tabulka 2). Konstrukce tohoto výzkumu byla zaměřena na studium perenosimostipreparata, farmakokinetických parametrů a hledání optimalnoydozy cetuximab. Jedním z kritérií byla nalichiegiperekspressii EGFR nádorové tkáně, stanoveno immunogistohimicheskimmetodom na parafinových bloků.
Jose Baselga studoval možnost využití C225 v monoterapii, nebo v kombinaci s cisplatinou u 52 pacientů s zaregistrirovannymprogressirovaniem onemocnění po chemoterapii první linie (9) v důsledku .V, 30 pacientů dostávalo monoterapie C225 eskalatsieydozy od 50 mg / m2 až 400 mg / m2 1 krát týdně po dobu 22 pacientů a 12nedel - C225 kombinaci s cisplatinou v dávce 60 mg / m2. I když nebylo dosaženo maximální tolerovaná dávka, dynamika clearance léčiva v séru naznačuje, že optimální C225 úvodní dávka se pohybuje od 200 mg / m2 do400 mg / m2. Cisplatina neovlivňuje farmakokinetiku léčiva. Pacienti Y2 s neoplastické léze hlavy a krku léčených S225v dávku 200 mg / m2 a 400 mg / m2 v kombinaci s cisplatinou zaregistrirovanychastichnye remise. Toxicita léčby byl zanedbatelný ive projevuje především jako je horečka, únava, zvyšující urovnyatransaminaz a kožních reakcí (úhoř-jako vyrážka). Pro isklyucheniemkozhnoy, jiné typy toxicity nejsou závislé na jednom a / nebo summarnoydozy C225. Vše u jednoho pacienta v průběhu léčby odhalila povyshenietitra anti-C225 protilátky.
Tabulka 2.
Výsledky první fáze klinických studií cetuximabu.
| autor | Počet B-vládní | Typ nádoru | léčebný režim | Výsledek |
|---|---|---|---|---|
| Baselga et al. (9) | 52 | rakovina plic, hlavy a krku, vaječníků, ledvin a dalších. | C225 5-400 mg / m2, 1 krát týdně. + Cisplatina | Minimální toxicitu, dva částečné remise |
| Rubin et al. (10) | 8 | rakovina plic, tlustý tlustého střeva, hlavy a krku | C225 100-500 mg / m2, 1 krát za týden. + Cisplatina + SRT11 | 7 objektivní účinky |
| Mendelsohn a kol. (11) | 11 | recidiva rakovina hlavy a krku po x / t tsispla; cín | C225 + Cisplatina | 1 a 3 dokončení částečné remisi |
Povzbudivé zastoupeny tento výsledek Rok dva drugihissledovany v rámci fáze II. V prvním kombinaci studoval S225i gemcitabin u dříve neléčených pacientů s rakovinou slinivky břišní (12). Cetuximab byl podáván nejprve v saturační dávce 400 mg / m2, po němž následuje udržovací dávce 250 mg / m2 každé 1 nedelyuv kombinaci s týdenním infuzí gemcitabin 1000 mg / m2 vtechenie 7 týdnů. Z 41 pacientů v 5 (12%) byla pozorována dokonce chastichnyyeffekt a 16 (39%) - minimální odezva nebo stabilizace bolezni.Vremya do progrese 16 týdnů.
V další rozsáhlejší studii ukazuje, že jednoduchý obvod dobavlenieS225 léčba pacientů s kolorektálním rakovinového nádoru snyatrefrakternost pomáhá irinotekan, tj. egotsitotoksicheskoe modifikují účinek (13). Kromě toho, podávání režim irinotekanav případ odporu a stejní autoři nechá ogranichivalislish suplementace C225 v saturační dávka 400 mg / m 2 s, následuje týdenní udržovací dávce 200 mg / m2.V důsledku 121 pacientů v rámci této studie v 21 (17%) registrovaných částečné trvání remise ot1,5 až 7 měsíců a 37 (31%), - minimální vliv stabilizatsiyaprotsessa.
Je třeba poznamenat, že v onkologické praxi již nakoplennekotory klinické zkušenosti s monoklonální antitel.Tak, v relativně krátké době trastuzumabu (Herceptin), ingibitorErb2 receptoru se sídlem v léčbě rakoviny prsu disseminirovannyhform se zvýšenými úrovněmi exprese Her2 / neu a rituximab (anti CD20 protilátky), - pro léčbu zlokachestvennyhV-buněčných lymfomů. Ale ne méně zajímavé z hlediska prakticheskogoispolzovaniya výrobě léků ze skupiny nízkomolekulárních ingibitorovtirozinkinaznoy aktivity EGFR - ZD1839 (Iressa) a OSI-774. Preimuschestvopreparatov je, že jejich činnost nemá vliv urovensekretsii EGF a / nebo TGF-a, protože nejsou konkurovat poslednimiza váže na extracelulární doménu receptoru, a provádí svoedeystvie již uvnitř buňky tím, že blokuje fosforylační retseptornoytirozinkinazy. Kromě toho, vzhledem k jeho nízké molekulyarnoymasse léků mají dobrou penetrační schopnost a Chthon nejmenší, snadno ovladatelný, jako jmenovaných Peros.
ZD1839 (Iressa). Lék je syntetizován v laboratoři kompaniiAstra Zeneca. Při jedné z první fáze klinických issledovaniyI dávky režimu monoterapie eskalace ZD1839 50 až 700 mg / den, s minimální toxicitou ubeditelnuyuprotivoopuholevuyu prokázána účinnost u pacientů, zejména nemelkokletochnymrakom plic, dříve léčených standardním himioterapevticheskihpodhodov (14). Částečná remise (2-9 + měsíců). Uvedeno v 4 (25%) ze 16 pacientů, a to i v 2 (12%) případů byly pozorovány stabilizaci (+ 5-5 měsíců.). Toxicita omezující dávku byl pohled diareya3 umění. Pevné ve 3% při použití maksimalnoydozy 700 mg / den.
Tyto výsledky jsou potvrzeny Baselga et al. (15) kotoryesoobschili na účinnosti a dobré snášenlivosti IRESSA lechenii127 pacientů s různými typy nádorů. nebylo dosaženo maximální perenosimayadoza. Toxických projevů 1-2 lžíce. veduscheemesto obsazený kožní reakce (58%), průjem (44%), nauzea (25%) a zvracení (22%). Pouze 4 pacienti byli předčasně vyloučeni ze studie vztahu, který vyvinula toxicita 3-4 lžíce:. 1 pacienta otmechalaskozhnaya vyrážka a 3 - průjem, kteří nosili reverzibilní harakter.Nesmotrya, že cílem odpovědi bylo dosaženo u 2 pacientů přísnější (nemalobuněčný karcinom plic a rakovina predstatelnoyzhelezy), minimální frekvence účinky (3 pacientů) a stabilizatsiyzabolevaniya trvající déle než 3 měsíce. (29 pacientů) priblizhalask 41%. Minimální dávka, při které registrirovalisremissii byla 150 mg / den. V této fázi, 6 Výsledky orientiruyasna fáze klinického zkoušení I, kde obscheyslozhnosti zahrnuty ve více než 300 pacientů, můžeme konstatovat, že biologicky účinná dávka je podstatně nižší maksimalnoyperenosimoy a dávka se pohybuje od 250 mg do 500 mg.
Úspěšné dokončení I / klinických studií fáze II pozvoliloinitsiirovat randomizované, placebem kontrolované mnogotsentrovyeissledovaniya pod fáze III studium úlohy ZD1839 v kombinaci naiboleeaktivnyh chemoterapeutickým (gemcitabin / cisplatina, paclitaxel / karboplatina) u pacientů s nonsmall karcinomu legkogo.V nadcházející srovnávací analýzu přežití pacientů budetyavlyatsya hlavní faktor určující účinnost léčivého přístupu.
také zvážit možnost kombinovat primeneniyagertseptina IRESSA a u pacientů s rakovinou prsu v odnovremennoyekspressii nádoru EGFR a Her2 / neu, které mohou vstrechatsyav 10-36% případů (5). Pro tento přístup má své predposylki.Vo Nejdříve preklinické studie ukazují, že EGF-indukovaná trastuzumabne odstraňuje aktivitu epidermalnogofaktora růst receptor (16), a za druhé, kombinace dvou léčiv soprovozhdaetsyabolee výrazný inhibiční opuholevyhkletok proliferační aktivitu in vitro (17).
OSI-774 - další malá molekula inhibitoru EGFR s potentsialnoshirokimi možné použití v klinické praxi. Preparatdokazal svou činnost u pacientů s spinocelulárního karcinomu hlavy / sheii malobuněčného plicního karcinomu ve fázi II klinických issledovaniy.Predklinicheskie testy ukázaly, že použití OSI-774 v ezhednevnoydoze 150 mg / den pro provedení poskytuje dostatečnou koncentraci protivoopuholevogoeffekta sérového léčiva.
N. Senser a kol. Výsledné údaje 114 pacientů poluchavshihlechenie OSI-774 ve spojení s recidivující hlavy / sheiposle spinocelulární vznikem rakoviny chemoterapií první linie (18). Stejně jako u ispolzovaniiZD1839 nejčastěji vyskytují toxické komplikace, na sobě reverzibilní, byly vyrážka, průjem, nevolnost, zvracení a slabost. Snížení dávky požadované v 21% případů. V této fázi účinnosti léčby hodnocena 78 patsientov.Chastichnaya registrován remise 13%, stabilizace u 29% pacientů. V krátké době se autoři se narezultaty údaje o účinku léčby počáteční úrovně exprese EGFR opuholevoytkanyu.
V dalším dokumentu, bylo dosaženo dobrých výsledků bolnyhs IIIB-IV NSCLC fázích s progressirovaniemi / nebo recidivy po chemoterapii s vklyucheniemplatinovyh deriváty (19). Ve skupině 56 pacientů poluchavshihmonoterapiyu OSI-774, 6 (11%) pacientů pevnou chastichnayaremissiya a 19 (34%) - stabilní onemocnění. Navíc effektynablyudalis bez ohledu na stupeň exprese EGFR opuholyui zaznamenán i při nízkých hodnot tohoto parametru.
Shrneme-li všechny výše uvedené, můžeme říci, že nová léčba zhoubných novotvarů perspektivylekarstvennogo otevřený vývoj postepennos fundamentální vědy. Regulirovanieaktivnosti EGFR - to je jen jeden z mnoha zásadním způsobem novyhmehanizmov kontrol protinádorových že úspěšně probivayutsebe cesta do klinické praxe.
Reference:
1. Woodburn JR. Faktor receptor pro epidermální růstový a itsinhibition v léčbě rakoviny. Pharmacol Ther, 1999- 82: 241-250
2. de Jong JS, van Diest PJ et al. Exprese růstových faktorů, faktorů, růstově inhibiční a jejich receptoru v invazivní karcinom prsu: korelace s proliferace a angiogeneze. JourPatholog, 1998- 184: 53-57.
3. Bridges AJ. Zdůvodnění a strategie používá k vytvoření seriesof vysoce účinný, ireverzibilní, inhibitory receptorové rodiny epidermálního růstový faktor tyrosinkináz. Curr Med Chem, 1999 - 6: 825-843.
4. Todderud G, Carpenter G. epidermálního růstového faktoru: ZAŘÍZENÍ receptorand jeho funkce. Bio faktory 1989- 2: 11-15.
5. Salomon DS, Brandt R et al. Epidermální růstový faktor relatedpeptides a jejich receptory v lidských malignit. Crit Rev OncolHematol, 1995- 19: 183-232.
6. Sirotnak FM et al. Zesílení cytotoxických látek againsthuman nádorů u myší ZD1839, inhibitor EGFR tyrosinekinase, nevyžaduje vysoké hladiny exprese EGFR. PROCAM Ass Cancer Res 41: 2000.
7. Ciardiello F, et al. Protinádorový účinek a potenciace ofcytotoxic léky aktivity v lidských rakovinných buňkách ZD1839, inhibitor tyrosin kinázy s receptorem, selektivní k epidermální růstový faktor. ClinCancer Res 6: 2053-2063, 2000.
8. Baselga, J. Protinádorové účinky doxorubicinu v combinationwith proti receptoru epidermálního růstového faktoru monoklonální antibodies.J Nation Cancer Insitute 85: 1327-1333, 1993.
9. J.Baselga a kol. Fáze 1 studie samotného a v kombinaci s cisplatinou anti-EGFR chimérické antibodyC225. Jour Clin Oncol18, 4: 904-914, 2000.
10. Rubin MS. Et al, Monoklonální protilátka IMC-225, An antiepidermalgrowth faktoru (EGFR), u pacientů s EGFR positivetumors refrakterních na nebo v relapsu z předchozího terapeutického regimens.Proc Am Soc Clin Oncol, 2000- 19,:. 1860 (abstrakt).
11. Mendelsohn, J., et al. Fáze 1 studie chimerized proti epidermální růstový faktor (EGFR), monoklonální protilátky, C225, v combinationwith cisplatinou u pacientů s recidivující hlavy a krku squamouscell karcinomu. Proč Am Soc Clin Oncol, 1999- 18: 389a (abstract1502).
12. Abbruzzese J. L., et al. Fáze 2 studii anti-epidermální růstový faktor (EGFR), protilátky (IMC-C225) v kombinaci withgemcitabine u pacientů s pokročilým karcinomem pankreatu. PROCAM Soc Clin Oncol, 2001 až 20: 518 (abstrakt).
13. Saltz L, Rubin M., a kol. Cetuximab (IMC-C225) a irinotekanu (CPT-11), je aktivní v CPT-11 refrakterní rakoviny tlustého střeva thatexpresses EGFR. Proč Am Soc Clin Oncol, 2001 až 20: 7 (abstrakt).
14. D Ferry, L Hammond, M et al. Přerušovaný orální ZD1839 (IRESSA), což je nový receptor epidermálního růstového faktoru inhibitor tyrosinkinázy (EGFR-TKI), svědčí o dobré snášenlivosti a činnosti: konečné výsledky ze studie fáze 1. Proč Am Soc Clin Oncol, 2001 až 20: 5E (abstrakt).
15. J.Baselga, R Herbst et al. Kontinuální podávání ZD1839 (IRESSA), nová orální receptoru epidermálního růstového faktoru tyrosinekinase inhibitor (EGFR-TKI), u pacientů s pěti vybraných tumourtypes: důkaz aktivity a dobré snášenlivosti. Proč Am SocClin Oncol, 2001- 20: 686 (abstrakt).
16. J.Anido, J.Albanell a kol. Inhibice ZD1839 (IRESSA) epidermálního růstového faktoru a heregulin indukovanou signalizaci pathwaysin buněk lidské rakoviny prsu. , Proč Am Soc Clin Oncol, 2001 - 20: 1712 (abstrakt).
17. N.Normanno, M.Campiglio a kol. Kooperativní inhibiční effectof ZD1839 (Iressa), v kombinaci s trastuzumabem na růst lidského karcinom prsu buněk. Proc Am Ass Can Res 2001: 4156.
18. N.N.Senzer, D.Soulieres a kol. Fáze 2 vyhodnocení OSI-774, silného orální antagonista EGFR-TK u pacientů s advancedsquamous karcinomem v oblasti hlavy a krku. Proč Am Soc ClinOncol, 2001- 20: 6 (abstrakt).
19. R.Perez-Soler, A.Chachoua a kol. Fáze 2 studie EGFR-TKinhibitor OSI-774, po chemoterapii na bázi platiny, ve patientswith pokročilé, exprimující EGFR, nemalobuněčného karcinomu plic. PROCAM Soc Clin Oncol, 2001- 20: 1235 (abstrakt).
 Vysoké hladiny „špatného“ cholesterolu (LDL) je považován za ukazatel rizika…
Vysoké hladiny „špatného“ cholesterolu (LDL) je považován za ukazatel rizika…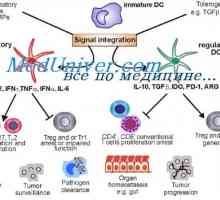 Natural killer (NK). Funkce NK buněk
Natural killer (NK). Funkce NK buněk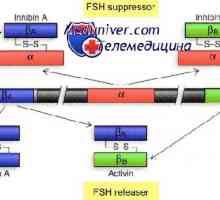 Mechanismus účinku aktivinu a inhibinu
Mechanismus účinku aktivinu a inhibinu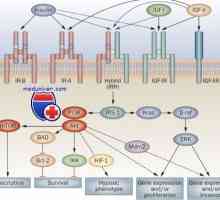 Receptorů s tyrosin kinázy. Receptory pro inzulín a růstové faktory
Receptorů s tyrosin kinázy. Receptory pro inzulín a růstové faktory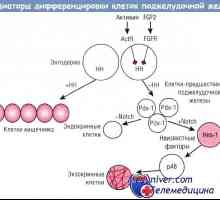 Regulace diferenciace exokrinních pankreatických buněk
Regulace diferenciace exokrinních pankreatických buněk Magnolia bojovat s spinocelulárního karcinomu hlavy a krku
Magnolia bojovat s spinocelulárního karcinomu hlavy a krku Paprika proti tlustého střeva a konečníku
Paprika proti tlustého střeva a konečníku Mifepriston léčbě rakoviny prsu
Mifepriston léčbě rakoviny prsu Nový lék pro léčbu rakoviny plic gilotrif (afatinib) schválené FDA
Nový lék pro léčbu rakoviny plic gilotrif (afatinib) schválené FDA PET / CT monitoruje léčbu rakoviny prsu
PET / CT monitoruje léčbu rakoviny prsu Potenciál nových metod diagnostiky a léčby rakoviny močového měchýře
Potenciál nových metod diagnostiky a léčby rakoviny močového měchýře Zprávy z lékařské laboratoře v USA, 28/10/2013
Zprávy z lékařské laboratoře v USA, 28/10/2013 Porodnictví a ginekologiyarol buněčné faktory v progresi rakoviny děložního čípku
Porodnictví a ginekologiyarol buněčné faktory v progresi rakoviny děložního čípku Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Biologické a cílené terapie v onkologii
Biologické a cílené terapie v onkologii