Onkologiya-
EI Podoltseva
Městská nemocnice číslo 31, St. Petersburg
zdroj RosOncoWeb.Ru
reakce "reakce štěpu proti leukemii" Po allogennoyperesadki kostní dřeněPoužití v posledních letech nemyeloablativní režimy himioterapiipri transplantaci hematopoetických kmenových buněk u solidních nádorů je lecheniyadisseminirovannyh logické zaversheniempochti padesát let experimentálních a klinických issledovaniyroli imunitní mechanismy novoobrazovaniyallogennoy v léčbě maligního transplantací kostní dřeně.
Barnes a Loutit byli první popisovat vliv "transplantatprotiv leukémie" (TPL). V roce 1956 se ukázalo, že myši vyzhivaemostleykoznyh výše, v případě, že se provádí transplantatsiyaot alogenních zdravých dárců ve srovnání s transplantací leukemické Myši poluchivshimisingennuyu.
Myšlenka použití TPL účinku u lidí při léčbě leukémie a izlecheniyaot alogenní transplantace kostní dřeně prinadlezhitGeorges Mathé, který poprvé v roce 1956, popsaný efekt TPL ubolnogo, obdržel o leukémii transplantace kostnogomozga. V následujícím transplantaci skupiny ze Seattlu zjistili, že pacienti, kteří podstoupili těžkou přehnanou reakci "hostitel transplantatprotiv" (GVHD), stejně jako u pacientů s chronickou RTPHimeli nižší úrovni relapsu ve srovnání s pacienty, kteří neměli těmto komplikacím. Nicméně, účinek TPL soznachitelnoy sdružování a často smrtelnými GVHD reakce entuziazmispolzovaniya omezené GVHD provokace snížit frekvenci retsidivovposle alogenní transplantací kostní dřeně.
V budoucnu se tento pohled byl zničen daty poluchennymiv dvou klíčových studií. V prvních velkých transplantace série, jejíž výsledky se analyzují mezinárodní registr transplantatsiikostnogo dřeň, bylo zjištěno, že pacienti s hronicheskimmieloleykozom (CML), kteří dostávali kostní dřeň ochuzeného o T-buněk (pro prevenci GVHD), pravděpodobnost, že recidivy onemocnění uvelichivalasv 7 krát ve srovnání s ti, kteří neměli projevy GVHD, po transplantaci kostní nesmotryana surový T dřeně. Etidannye demonstroval možný nedostatek silného komunikace zprostředkované lymfocyty, TPL efekt vývoje GVHD (Harowitzi al., 1990). Pozorováním Kolb et al. (1990, 1995) zjistili, že u pacientů s relabujícím CML po transplantaci kostní dřeně, je možné získat stabilní remisi výsledného infuzního donorskihlimfotsitov.
Infúze dárcovských lymfocytů také Porteri spoluautory byl úspěšně aplikován (1999) pro indukci remise u pacientů s akutním ihronicheskim leukémie, lymfomu a myelomu relapsu transplantaci posleallogennoy kostní dřeně, a v mnoha (esline ve všech případech), maligní Onemocnění krovipodvergalis účinků TPL reakcí.
reakce "reakce štěpu proti nádoru"
Existuje reálná možnost vyvolání efektu analogichnyyTPL proti non-hematologických nádorů? V současné době existuje vremeniustanovleno, že v některých případech, nádorové metastázy infiltriruyutsyaT buňky, a jejich regrese, zřejmě způsobená těmito lymfocyty (Vose, Moore, 1985). Proto lze předpokládat, že allogennyeT lymfocyty mohou také ovlivnit nádor. Podtverzhdeniemsuschestvovaniya reakce "reakce štěpu proti nádoru"(TPO) je skutečnost, že pevné nádory vznikající v organahi tkáních, které jsou cílovými orgány GVHD mají stejnou tkanespetsificheskieantigeny, které jsou rovnoměrně vystaveny útoku tsitotoksicheskimilimfotsitami.
V posledních letech jsme vyrobili nějaký experimentální důkaz pro existenci TPO efektu. Tak Morecki a Slavín (1997, 1998) úspěšně generován TPO reakci u myší s prostaty adenokartsinomoymolochnoy po alogenní transplantaci. Zároveň se jednotlivci, kteří obdrželi allogenních buněk sleziny, není razvivalismetastazy v plicích, a významně zvyšuje míru přežití vsledstvieeffektivnoy eliminaci minimální reziduální allogennymikletkami onemocnění. Výsledky získané Bartels et al (1996), také ukazují prevenci metastáz legkihu myši transplantované s buněčnou linií myelomu MC-38 posleinfuzii alogenní lymfocyty stimulované nádorových buněk.
Aloimunitní a autoimunitní protinádorová odpověď
Od této chvíle se dostatečný argument ve podderzhkupredpolozheniya že alogenní imunitní systém okazyvaetbolee silný účinek TPO než imunitní systém příjemce. Za prvé, dárcovské buňky imunitního systému nemají toleranci na nádorové buňky, a to i v případě, takový rozvíjí tolerance po transplantaci, je zde možnost opětovného lomu čerstvé infuze donorskihlimfotsitov k úplné destrukci nádoru. Je také možné, predvaritelnayavaktsinatsiya dárce specifické nádorové antigeny, které yavlyaetsyabolee účinnější než očkování pacienta. Za druhé, antigennyyrepertuar schopné vyvolat imunitní odpověď, protinádorovou mnohem více v alogenní transplantací a zvyšuje se uvelicheniemantigennoy nekompatibility. Transplantované dárce T kletkirazlichayut nejen antigeny specifické pro nádor, ale také alelické varianty těchto antigenů kompleksagistosovmestimosti menší antigeny, tkáňově specifické vyjádřený retsipientom.V případ neslučitelnosti antigenů hlavního komplexu gistosovmestimostiopuholevye příjemce buňky exprimují také různé HLAantigeny. Rozdíly v HLA-C a HLA-DR u pacientů s alogenní transplantací"zřetelně" natural killer dárce kletkami.V výsledek alogenní imunitní odpověď se podstatně zvýší, například, HLA související haploidentických transplantaci ochischennyhot T lymfocytů kmenové buňky, které mohou bytvazhnym složka TPO účinek (Ruggeri a spol., 1999).
Alogenní krvetvorných buněk nádorů prisolidnyh
Alogenní krvetvorných-buněčných zhoubných bujení prinegematologicheskih vypolnyalasnemnogimi výzkumníky z důvodu vysoké úmrtnosti pacientů prietom způsobu léčby. To znamená, že dvě skupiny ispolzovaliallogennuyu transplantaci transplantaci kostní dřeně u prsní zhelezy.Pri tento Eibl a spolupracovníci (1996) byli první popisovat effektTPO u žen s metastatickým karcinomem prsu po vysokodoznoyradio chemoterapie s alogenní kostní mozgaot příbuzné dárce HLA-identický. Autoři pozorovány znachitelnoeumenshenie jaterní metastázy, které vyvinuté v kontextu GVHD. Byloustanovleno že lymfocytů v období po transplantaci proyavlyalispetsificheskuyu Cytotoxická aktivita proti buněčné linie karcinomu rakamolochnoy, která potvrdila přítomnost odezvy nádoru spetsificheskogoallogennogo u tohoto pacienta. Ueno et al (1998), M. D. izrakovogo centrum Anderson (USA) je také používán vysokodoznuyuradio-chemoterapie transplantace kostní dřeně u alogenní mozgav léčbě pacientů s karcinomem prsu. Unekotoryh pacienti dostali odpověď, pravděpodobně obuslovlennyyTPO efekt, ale úmrtnost v této skupině pacientů, svyazannayas transplantace byla vysoká. V poslední době, Bay et al (2000), získané výsledky ukazují, regresní opuholevoymassy a stabilní remisi u pacientů s metastatickým kartsinomoyyaichnika po alogenní transplantaci a rozvoj GVHD. All etirezultaty konflikt s údaji získanými priallogennoy transplantace u dětí s neuroblastomu. Vysoká chastotaretsidivov po vysokodávkovanou chemoterapií a autologní kmenové buňky transplantatsiigemopoeticheskih pacienti s neuroblastomu IVstadii bylo zjištěno, spojené s kontaminací autotransplantataopuholevymi buňkami. V tomto ohledu některé issledovateliprimenili alogenní transplantace kostní dřeně od HLA-dárce identichnogorodstvennogo jako alternativní léčbu bolnyhs neuroblastomu (Kremens et al., 1997- Matthay et al., 1994- Moritakei kol., 1998). Nicméně, když se porovnají výsledky ošetření autologichnoyi alogenní transplantace dat na přítomnost TPO efekt poluchenone byl. Tyto předběžné údaje naznačují, že TPO chtopriroda stupně a účinku v různých nádorech chrezvychaynovariruyut.
Non-myeloablativní transplantace hematopoetických kmenových buněk (NTGSK) v léčbě metastatického karcinomu
Počínaje od pojmu možné velmi vysoké effektivnostireaktsii TPO, několik skupin svět transplantaci popytalisproverit hypotéza, že v alogenní transplantací eliminatsiyaopuholevyh buňky mohou téměř úplně být effektomTPO místo chemoterapie vysoké dávky. Tento přístup vyžaduje primeneniyanemieloablativnoy imunosuprese v přípravě bolnogodlya transplantaci, čímž se přihojení transplantata.S tento účel použití různých režimů konditsionirovaniyas zahrnutí anti-thymocytů globulin a méně než pristandartnoy Alogenní transplantace dávky tsitostaticheskihpreparatov :. busulfan, cyklofosfamid, atd V budoucnosti, až primenenieflyudarabina před transplantací příprava pacientů prokázala, že lék je ještě silnější a chrezvych ino horoshoperenosimym imunosupresiva. Kromě toho, fludarabin obladaetvelikolepnym protinádorový účinek v některých variantahleykozov. Předpokládá se, že toto je jeden z léků ve vývoji, který prinadlezhitbuduschee nemyeloablativní transplantaci (Slavín, 2001) .Posttransplantatsionnaya imunosuprese pro prevenci GVHD bylaminimalnoy, které přispěly k rychlé a úplné vosstanovleniyuimmunnoy systému a rozvoj TPO efektu. Následně avtoryvypolnyali infúze dárcovských lymfocytů pro další obespecheniyareaktsii imunitního systému TPO v důsledku konverze 100% dárců retsipientav (Barret, Childs, 2001). Jako výsledek eksperimentalnogolecheniya solidních nádorů takové strategie nemyeloablativní transplantatsiiimela zřejmá výhoda oproti standardním alogenní transplantatsieys využitím intenzivní myeloablativní () způsobů chemo-a radioterapii u pacientů s karcinomem, kteří pozorovatelné zvýšení reakce protinádorové i při naraschivaniidoz chemoterapie. NTGSK byl také použit u pacientů s karcinomem metastaticheskoypochechno buněk a melanomu. Tyto nádory byly vybranyiz jejich imunogenicity. V tomto případě, pacienti nereagují na immunomoduliruyuschuyuterapiyu IL-2 nebo interferon, standardní chemoterapie byla takzheneeffektivna. Autoři se pokusili zvýšit reakci TPO ispolzuyav Allograft krvetvorných kletkis vysokou koncentraci T lymfocytů. Přes obschiystatus pacientů chudé před transplantací, jsou relativně horoshoya s minimálními toxicitě přesunuta predtransplantatsionnuyuhimioterapiyu. Během prvních 30 dnů po transplantaci priznakovprogressirovaniya onemocnění u těchto pacientů neměl bylo.V následné významný účinek byl získán v 10 z 19 pacientů, z nichž 3 - kompletní remise se zmizením všech lézí metastaticheskihochagov, 7 - částečnou odpověď. Účinek TPO razvivalsyacherez 3-6 měsíců po transplantaci, obvykle po zrušení immunosupressivnogolecheniya cyklosporin a přesunout pacienta ze smíšené do polnomuT buněk chimerismu. Projevy akutní GVHD v těchto bolnyhassotsiirovalis reakce TPO, ale jeden pacient bylapoluchena kompletní remisi bez akutní GVHD, a mají několik bolnyhotmechalas regrese onemocnění po několika měsících poslerazresheniya akutní GVHD (Barret, Childs, 2001).
NTGSK byla také provedena u 15 pacientů s metastatickým refrakternoymelanomoy (Barret, Childs, 2001). Zároveň zemřelo 12 pacientů otprogressirovaniya onemocnění, dva - od transplantaci komplikace svyazannyhs. PosleNTGSK rychlost progrese onemocnění u pacientů s metastatickým melanomem vyzyvaetsomneniya účinnost této léčebné metody (Barret, Childs, 2001).
Výsledky léčby pevných nádorů s použitím NTGSKsvidetelstvuyut extrémní variabilita TPO účinku. V nastoyascheevremya žádné jasné prognostických ukazatelů, reagující na takové studie lechenie.Poetomu NTGSK účinnosti při různých metastaticheskihopuholyah (včetně sarkom měkkých tkání, adenokarcinom, epitelialnyeraki) prochází.
Důvod pro použití transplantatsiigemopoetichekih nemyeloablativní kmenových buněk v léčbě pacientů metastaticheskimrakom jsou: 1) nízká mortalita (2,5%) v posttransplantatsionnomperiode (Barret et al, 2001), - 2) možný dopad na odolné proti intenzivní chemoterapie v důsledku reaktsiiTPO- 3) opuholevyekletki. tento způsob léčby je základem pro imunoterapii dalneyshegorazvitiya malignit. Takže výsledky poluchennyepervye léčby pacientů s maligním NTGSK novoobrazovaniyamisvidetelstvuyut negativním dopadem imunosuprese na proyavleniyaeffekta TPO. V tomto ohledu nedávné rassmatrivayutsyasleduyuschie kroky k rozvoji této léčby:
1) úplné vyloučení posttransplantatsionnomperiode v imunosupresivní terapii v důsledku odstranění transplantaci alloreaktivních buněk způsobujících GVHD;
2) rovnoběžně s eliminací T-buněk zodpovědných za GVHD kapacity v koncentraci štěpu buněk, reaktantu stkanespetsificheskimi nádorové antigeny a definování reaktsiyuTPO;
3) zlepšení identifikace nádorových antigenů, tumor-spetsificheskimitsitotoksicheskimi sootvetstvuyuschimantigenom lymfocytů očkováním. A v daleké budoucnosti - vytvoření spetsificheskihT nádorových buněk, které umožňují pro adaptivní imunoterapii bez transplantaci imunosuprese hematopoetických kmenových buněk (Barret, Childs, 2001).
 Transplantace kostní dřeně zachránil chlapce před alergiemi
Transplantace kostní dřeně zachránil chlapce před alergiemi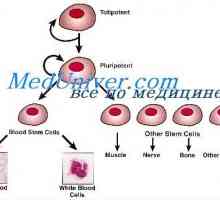 Sebeobnovy kmenových buněk. Proliferační schopnost kmenových buněk
Sebeobnovy kmenových buněk. Proliferační schopnost kmenových buněk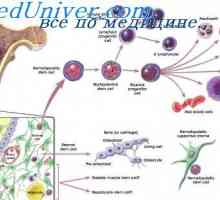 Lymfatické předci. Původ krvinek
Lymfatické předci. Původ krvinek Původ a mikroprostředí buňky. Fibroblasty z lymfatických orgánů
Původ a mikroprostředí buňky. Fibroblasty z lymfatických orgánů In-supresor buněk. Potlačení imunitní reakce lymfocytů
In-supresor buněk. Potlačení imunitní reakce lymfocytů Vlastnosti spolupráce imunitní buňky. Humorální faktor protilátky
Vlastnosti spolupráce imunitní buňky. Humorální faktor protilátky Účast kostní dřeně v imunitní odpovědi. Stimulující mechanismus kostní dřeně
Účast kostní dřeně v imunitní odpovědi. Stimulující mechanismus kostní dřeně Štítné žlázy, imunitní systém po transplantaci kmenových buněk
Štítné žlázy, imunitní systém po transplantaci kmenových buněk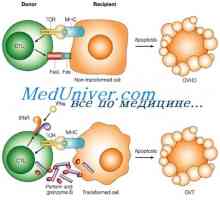 Imunosuprese. Příprava pro transplantaci a methotrexatu
Imunosuprese. Příprava pro transplantaci a methotrexatu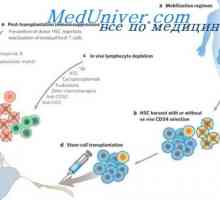 Poruchy nervové soustavy a růst zhoubných nádorů po transplantaci kmenových buněk
Poruchy nervové soustavy a růst zhoubných nádorů po transplantaci kmenových buněk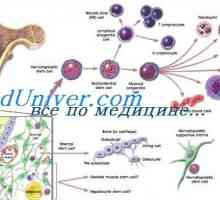 Transplantace krve kmenových buněk v aplastické anémie
Transplantace krve kmenových buněk v aplastické anémie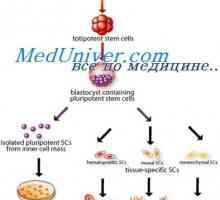 Transplantace kmenových buněk v imunodeficience a anémie Fanconiho
Transplantace kmenových buněk v imunodeficience a anémie Fanconiho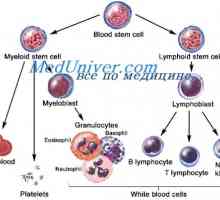 Transplantace kmenových buněk pro akutní leukemie
Transplantace kmenových buněk pro akutní leukemie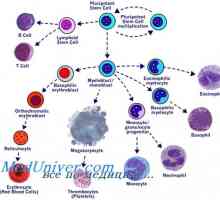 Transplantace kmenových buněk v myeloproliferativní onemocnění mieloleykoze
Transplantace kmenových buněk v myeloproliferativní onemocnění mieloleykoze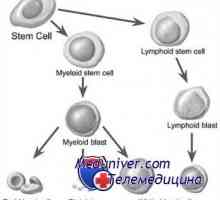 Transplantace kmenových buněk neuroblastomu a nádorů mozku
Transplantace kmenových buněk neuroblastomu a nádorů mozku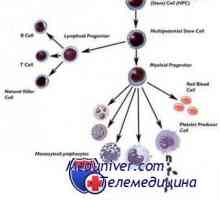 Transplantace kmenových buněk pro akumulaci onemocnění a talasemie
Transplantace kmenových buněk pro akumulaci onemocnění a talasemie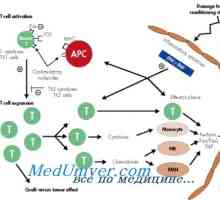 Chronické onemocnění štěpu proti hostiteli (GVHD)
Chronické onemocnění štěpu proti hostiteli (GVHD) Hematologie-working klasifikace hematologických malignit
Hematologie-working klasifikace hematologických malignit Onkologiya-
Onkologiya- Nádory krvetvorby
Nádory krvetvorby Králík virus bude transplantace kostní dřeně bezpečnější
Králík virus bude transplantace kostní dřeně bezpečnější