Hormonální terapie v onkologii

Hormonální terapie v onkologii.
- úvod
- Druhy hormonální terapii
- Předpovídání účinnost hormonální terapie
- Odolnost vůči hormonální terapii
- sporné otázky
úvod
Hormony hrají důležitou roli při vzniku a růstu mnoha druhů rakoviny, včetně rakoviny pochvy, vaječníků, štítné žlázy, slinivky břišní a různé gastrointestinální, melanomu a meningiom. Nejpřesvědčivějším důkazem o stimulačním účinkem na růst nádorových hormonů je spojení mezi pohlavní hormony a cílových rakovina orgánů hormonů, zejména mezi estrogeny a progestiny a karcinomu prsu a karcinomu endometria a prostaty androgenu. Cílem hormonální terapie u zhoubných nádorů je minimalizovat obsah hormonu v krvi, stimuluje růst nádoru nebo blokování vazby hormonu na receptory v nádorových buňkách. V obou případech je možné dosáhnout regrese nádoru inhibicí proliferace nádorových buněk a indukci apoptózy.
Principy hormonální terapii maligních nádorů:
- možno dosáhnout snížení hormonu, který stimuluje proliferaci buněk, nebo blokovat vazbu hormonu s buněčnými receptory;
- potlačuje buněčnou proliferaci a indukovat programovanou smrt nádorových buněk.
Vliv hormonální substituční terapie je obvykle omezena na specifické cílové orgány, hormon, ale vedlejší účinky spojené s poruchou funkce jiných orgánů, jsou vzácné. Je to díky lepší snášenlivosti hormonální terapie ve srovnání s chemoterapií. Kromě toho, hormonální terapie, a to i v pokročilé malignity může dát trvalý protinádorový účinek. Někdy však nádor, která se vyvinula v těle hormonálně podmíněné je odolný vůči hormonální terapii od začátku nebo relapsu nebo postupně ztrácí citlivost na hormonální léky v procesu léčby. To znamená, že většina pacientů s karcinomem prsu a rakoviny prostaty, nejsou citlivé na hormony, umírají.
Nádorů, které jsou citlivé na hormony
Pohlavní hormony:
- Rakovina prsu a prostaty, rakovina endometria;
- rakovinu ledvin, meningiom. Peptidové hormony:
- rakovina štítné žlázy, neuroendokrinní nádory, karcinoid.
Druhy hormonální terapii
ablace endokrinní
Muži a ženy před menopauzou hlavní syntézy pohlavní hormon místo jsou pohlavní žlázy. Po kastraci testosteronu v krvi u mužů klesá více než 95% a u žen před menopauzou estrogenu snížena o 60% (v závislosti na úrovni v ovariální folikulární fázi cyklu). Tyto změny endokrinní způsobit klinické zlepšení ve výši přibližně 80% pacientů s karcinomem prostaty a 30-40% premenopauzálních pacientek s krajně pokročilým karcinomem prsu. Vaječníků, rakoviny prsu u žen po menopauze je neúčinné, protože množství estrogenu vaječníky mírně syntetizovaných.
V případě pokročilého karcinomu prsu u žen po menopauze se začaly provádět adrenalektomií a hypofysektomii, vzhledem k tomu, že u žen po menopauze, estrogeny jsou produkovány v nadledvinách. Klinický efekt po těchto zákroků byla pozorována u jedné třetiny pacientů, ale operace je spojena s vysokým rizikem komplikací a, kromě sekrece pohlavních hormonů a eliminuje další hormony. Dosažení klinický účinek nenastává u všech pacientů, a nevratné poškození hormonální profil po odstranění endokrinní orgán byl impuls pro vývoj alternativních způsobů léčby, zejména léčiva, které je konkrétnější způsobují reverzibilní změny v hormonálních hladin. Takže pokud farmakoterapie je neúčinná, zrušení drog vede k obnovení normálních hladin hormonů a tím pomáhá předcházet závažné nežádoucí účinky.
Léčení vysokými dávkami agonistů hormonu
Hormonu uvolňujícího gonadotropin - luteinizačního (LH) a folikuly stimulujícího hormonu (FSH), hormon - stimuluje syntézu ovariálních hormonů estrogenu. Syntéza a sekrece gonadotropního hormonu hypofýzou, podle pořadí, je regulován v hypothalamu, hormonu uvolňujícího gonadotropin (nebo moteniiziruyuschim uvolňující hormon). Vysoce aktivní agonisty GnRH syntetizované nahrazením nich nesprávné aminokyselin. Při přiřazování těchto agonistů na krátkou dobu, které způsobují rychlé uvolňování gonadotropinů, ale dlouhodobé úkol snížit citlivost receptorů hormonů v hypofýze. Výsledkem je, že hladiny gonadotropinů pádů potlačena jejich stimulační účinek na vaječníky, koncentrace pohlavních hormonů v krvi dosáhne hladiny, vyznačené na kastraci. V současnosti dostupné formulace agonisty GnRH, dlouhodobě působící injekce, což umožňuje jeden pro dosažení a udržení dlouhodobé účinky lékařské kastrace. Použití agonistů GnRH v karcinomu prsu u premenopauzálních žen a rakoviny prostaty umožňuje získat protinádorového účinku ekvivalentní chirurgické kastrace.
Podobný mechanismus působení v hormonálně závislých nádorů podkladem protinádorového účinku farmakologických dávek pohlavních hormonů, jako jsou:
- estrogeny (diethylstilbestrol);
- progestiny (medroxyprogesteron a megestrol);
- androgeny (fluoxymesteron a testolakton).
Nižší, fyziologické dávky těchto hormonů mohou urychlit růst nádoru.
Kromě specifického účinku hormonu, které se projevují ve snížení citlivosti receptoru v cílových orgánech, tyto léky mohou mít nespecifické účinky a zvyšuje sklon k žilní trombózy. Dále, jejich přiřazení může zpočátku posílení růstu nádoru. I přes to, že jsou účinné v klinické aplikaci (například vysoké dávky progestiny - rakoviny endometria a rakoviny prsu).
Inhibice enzymů zapojených do syntézy pohlavních hormonů
Tento přístup může být ilustrován inhibitory aromatázy. Aromatázy - enzym, který konvertuje androgenů na estrogeny, který je posledním článkem v syntéze pohlavních hormonů. U žen po menopauze, estrogeny jsou tvořeny hlavně mechanismem aromatázy. Proto je inhibice aromatázy - nejkonkrétnější způsob potlačení syntézy estrogenu. Vzhledem k tomu, biosyntéza estrogenů může dojít také v ne endokrinní tkáně, jako jsou tukové a nádoru (zejména u žen po menopauze), a pak za použití inhibitorů aromatázy lze dosáhnout většího snížení estrogenu, než adrenalektomie.
Vyvinutý dva základní typy inhibitorů aromatázy.
- Steroid, nebo inhibitory typu I, - narušit vazbu androgenů (substrátu) se katalytickém místě enzymu.
- Nesteroidní nebo typ II inhibitory - inhibují systém interagovat s enzymy cytochromu P450.
Farmakologická aktivita a specifičnost prvních inhibitorů typu II, jako je aminoglutethimid, byly nízké. Potlačují aktivitu jiných enzymů zapojených do metabolických konverze steroidů a které mají podobné protetické skupiny cytochromu P450 proto nutné přiřadit substituční terapii. Moderní inhibitory aromatázy typu II - triazolové deriváty (anastrozol, letrozol, vorozol), - na své době aktivita 2000 vynikající aminoglutethimid a mají různé stupně afinity pro cytochrom P450 aromatázy selektivně inhibující biosyntézu estrogenu. U těchto přípravků lze dosáhnout poklesu estrogenu po menopauze v koncentraci nižší, než je prahová úroveň bez ovlivnění koncentrace ostatních steroidních hormonů.
Inhibitory aromatázy typu I formestan a exemestan jsou považovány za „sebevražedné“ inhibitory za působení aromatázy, které jsou rozděleny do aktivních meziproduktů, blokuje. Biosyntéza estrogenů může být obnoveno pouze po vytvoření aromatázy molekul de novo.
Antagonisté steroidních pohlavních hormonů
Tato skupina léků blokují účinky pohlavních hormonů mají tendenci být na jejich úrovni receptorů. antagonisté estrogenu byly syntetizovány, progestin a androgenní receptory. Nejvýznamnější byly získány zkušenosti na použití anti-estrogenu tamoxifen pro rakovinu prsu. Tamoxifen se váže na estrogenní receptory a blokuje účinky endogenních estrogenů. Klinický účinek je pravděpodobnější pro nádory, které mají estrogenové receptory.
Tamoxifen je neúplný blokáda estrogenu a trofický akce se může projevit v části estrogenní aktivitu, zejména při nízké množství endogenního estrogenu. Toto je kvůli ochranný účinek tamoxifenu na kosti (zabraňuje osteoporózy), stejně jako nežádoucí stimulační účinek na proliferaci endometria, což může způsobit tvorbu polypů a (zřídka) karcinomu endometria. Přípravky připravené s vyšší „čistý“ antiestrogenní aktivitu, například fulvestrant úplného blokování regulační účinek na estrogenový receptor transkripci. Tento lék může být účinná u některých pacientů s karcinomem prsu, jejichž nádory rezistentní vůči tamoxifen.
Antiandrogeny, jako je flutamid, Casodex a jsou účinné pro rakovinu prostaty. Anti-progestiny, jako je RU-486 a onapristonu, byly použity k léčbě rakoviny prsu a endometria.
Vyberte typ hormonální terapie
- Kastrace (chirurgická nebo zdravotní).
- Blokáda syntézy, například aromatázy reakci.
- Blokáda pohlavních hormonů receptory.
- Kombinovaná terapie.
Video: O hormonální substituční terapie
Monoterapie a kombinované hormonální terapie
na to, že v mnoha nádorů, chemoterapie je účinnější než monotorapiya základě, se předpokládá, že kombinovaná hormonální terapie bude také účinnější než monoterapie. Ve skutečnosti je ve většině případů kombinovat jmenování několika hormonální terapie vede pouze ke zvýšení jejich toxicity bez významného vlivu na účinnost léčby. Nicméně, existuje několik výjimek z tohoto pravidla.
rakoviny prsní
V případě pokročilého karcinomu prsu u žen před menopauzou je kastrace v kombinaci s tamoxifen je účinnější než buď samotné léčby.
Kombinované tamoxifen a inhibitory aromatázy v pokročilé rakoviny nemají žádné výhody nad jmenováním pouze inhibitory aromatázy v pokročilém procesu nebo adjuvantní terapie.
Díky řadě typů hormonů po předem neúspěšné léčby rakoviny krajně uplynulý přidělení druhého a třetího přípravky mohou být účinné.
rakovina prostaty
Kastrace v souvislosti s jmenováním antiandrogen nemá žádné významné výhody ve srovnání s provedením pouze kastraci.
Suplementace po kastraci anti-androgenu v progresivní nádorový růst, může být účinná.
Předpovídání účinnost hormonální terapie
Vzhledem k tomu, hormonální terapie je účinnější, když ne všechny nádory, přiřadit ke všem pacientům bez rozdílu - znamená, podrobit pacientů s nádory rezistentními k nepřiměřenému riziku vedlejších účinků a zpoždění při léčbě jiných, snad účinnějších metod, jako je například chemoterapie.
Video: Hormonální léčba hypotyreózy - hormonální terapie, obezita s hypotyreózy
V současné době jsme se ještě odhalil absolutní biologické markery, které přesně předpovědět účinnost hormonální terapie. V případě rakoviny prsu nejčastěji používá prediktorem jsou estrogenového receptoru (ER). V 60-75% pacientů s karcinomem prsu je ER nádor, detekován pomocí biochemických nebo imunohistochemických metod. Pokročilý ER-pozitivních nádorů přístupný hormonální terapii u dvou třetin případů, zatímco když ER-negativní nádory, hormonální terapie je účinná je méně než 10% případů. Nejčastěji citlivé na hormonální terapii nádorů, jejichž buňky exprimují jak estrogen a receptorů progesteronu (PR). Většina ER-negativní nádory, které jsou citlivé na hormonální terapii, je PR-pozitivní.
Význam dalších markerů, například receptory progesteronu v endometriu rakoviny, je dostatečně jasné, a role androgen receptorů v předpovídání účinné a hormonální substituční terapie u karcinomu prostaty nebyla dosud prokázána.
Reakce na hormonální léčbu dříve provedeny a trvání relapsu období bez lze předvídat účinnost hormonální terapie druhé řady. Zatímco progrese nádoru během terapie s hormonální drogové první řadě znamená, že to bude relativně rezistentní na jiné hormonální léky, účinky hormonálních léků do druhého řádku v 30-40% případů, a třetí - na 20-30%.
Odolnost vůči hormonální terapii
Odolnost vůči hormonální terapii může být primární (odpověď na hormonální léčbu chybí na začátku) a získané (i přes počáteční odpovědi na hormonální terapie při léčbě nádoru začne znovu stoupat). Několik mechanismů rezistence.
primární rezistence
Jako výsledek mutace začíná hormonálně nezávislého proliferace nádorových buněk se ztrátou hormonálních receptorů, nebo bez ní.
hormonální přenos signálu cesta je zachována, ale vnímání signálu je rozdělen (například v důsledku hormonálních receptorů mutace).
Stimulace nehormonální signálních drah, jako jsou například „šumu“ spojené s přítomností určitého počtu receptorů růstových faktorů [in vitro prokázala možnost vzájemného rušení ER a receptoru epidermálního růstového faktoru (EGFR) u karcinomu prsu].
získaná rezistence
Klonální selekce signálních drah je uvedeno výše.
Zvýšená produkce hormonu nebo hormonální receptor.
Narušení interakce mezi hormon a jeho receptor, se buňky paradoxní reakce na působení antagonisty hormonu (je to potvrzeno klinickými pozorováními u pacientů s pokročilým karcinomem prsu, tamoxifen při jeho převrácení, a u pacientů s pokročilou rakovinou prostaty, při jeho převrácení blokátory androgenního receptoru).
Indukce enzymů podílejících se na antagonisty biotransformace hormonu, což vede ke snížení intracelulární koncentrace.
sporné otázky
Trvání adjuvantní terapie
Pokud deprivace hormonální terapie cytostatiky, ale není cytotoxický, neměl by být přerušen. Námitka tohoto přístupu - schopnost vyvinout rezistenci vůči hormonální léky při dlouhodobém užívání ní spojenou se současným změnám ve fenotypu nádorových buněk. Proto větší účinek lze dosáhnout zrušením některé přípravky a pokračování hormonální terapii s jinými léky, pro které neexistuje zkřížená rezistence.
terapie Himiogormonalnaya
Účinnost hormonální terapie a chemoterapie v kombinaci výhod sloužit jako základ pro jmenování onkologicky nemocných himiogormonalnoy terapii. Nicméně, hormonální látky, inhibice růstu nádorových buněk může oslabit účinek chemoterapeutických činidel, která činnost probíhá, zejména ve vztahu k dělících se buněk. Platnost tyto obavy indikován pro adjuvantní léčbu pacientů s rakovinou prsu. Obecně platí, chemoterapie a hormonální nejlépe provádí postupně a nikoli současně, a hormonální terapie se podává po dokončení chemoterapie.
 Regulace sekrece hormonů. Negativní zpětná vazba je, když sekrece hormonu
Regulace sekrece hormonů. Negativní zpětná vazba je, když sekrece hormonu Chemické posly v těle. hormony
Chemické posly v těle. hormony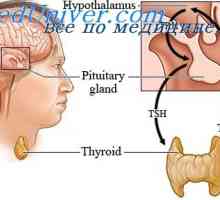 Antithyreoidika. Inhibice funkce štítné žlázy
Antithyreoidika. Inhibice funkce štítné žlázy Rakovina štítné žlázy: příčiny, příznaky a léčba
Rakovina štítné žlázy: příčiny, příznaky a léčba Hormonální léky jsou nebezpečné rakovina
Hormonální léky jsou nebezpečné rakovina Hormon řídí rakoviny tlustého střeva
Hormon řídí rakoviny tlustého střeva NSAID snížit riziko recidivy rakoviny prsu
NSAID snížit riziko recidivy rakoviny prsu Lék proti cholesterolu zastaví rakovinu
Lék proti cholesterolu zastaví rakovinu Hormonální substituční terapie v menopauze
Hormonální substituční terapie v menopauze Hormonální terapie při léčbě rakoviny prsu
Hormonální terapie při léčbě rakoviny prsu Jako hormony působí
Jako hormony působí Etiologie a patogeneze nádorů ledvin
Etiologie a patogeneze nádorů ledvin Radiační a farmakoterapie ledvin nádor
Radiační a farmakoterapie ledvin nádor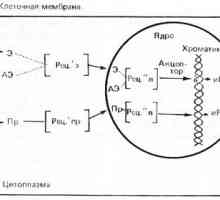 Estpadiola receptory a progesteronu v hormonálně závislých nádorů
Estpadiola receptory a progesteronu v hormonálně závislých nádorů V praxi se počet nádorových hormonální léky, především androgeny (viz. Přípravy mužské pohlavní…
V praxi se počet nádorových hormonální léky, především androgeny (viz. Přípravy mužské pohlavní… Onkologiya-
Onkologiya- Onkologiya-
Onkologiya- Hormonální terapie nezlepší paměť v menopauze
Hormonální terapie nezlepší paměť v menopauze Chmelové šištice v menopauze
Chmelové šištice v menopauze Ektopických syndromy
Ektopických syndromy Nádory neuroendokrinních buněk (koncept systému apud)
Nádory neuroendokrinních buněk (koncept systému apud)