Imunoglobulin lehké řetězce. Organizace imunoglobuliny
Video: Organizace a exprese imunoglobulinových genů 2 těžkého řetězce WMV V9
V- a C-oblast lehkého řetězce přibližně stejné délky. Tak, pro lidské V-oblasti V kappa řetězce sestaveny z částí 107-113 aminokyseliny (počítáno od N-koncového konce), a na C-oblast tvoří zbývajících 107 zbytků. V těžkých gama délkou řetězce V-oblastí je přibližně stejná, jako oblast C se skládá ze tří lineárně uspořádané za sebou homologními oblastmi C1, C2, C3 podobnou délku, strukturně homologní s C-oblasti lehkého řetězce a jeden s druhým.
V-oblast lehkého kappa a lambda řetězce se liší od sebe navzájem, a které jsou odlišné od těch z těžkých řetězců, zatímco V-oblast těžkého řetězce, jsou stejné pro všechny třídy.
Video: Immunology - protilátka Somatická (VDJ) rekombinace I
mezi plic řetězy, isolovány z různých patologických imunoglobulinů, nikdo, podobně jako ostatní. Odhaduje se, že jiný idiotypové varianty existují přinejmenším několik tisíc. Navzdory této rozmanitosti, všechny varianty V-oblasti řetězce kappa, vejde do tří hlavních podskupin, rozdíly mezi proteiny každé podskupiny je malý.
Stejným způsobem je možné zařadit V oblast lambda řetězce, a v poslední době, V-oblast těžkého řetězce.
aminokyselina výměna, podmíněno tím, že rozdíly mezi V-domény, většina z nich jsou seskupeny v několika specifických místech - tzv horkých míst. V lehkých řetězců, tyto hypervariabilní úseky zaujímají pozice 25-35, 52-55 a 89-96, zatímco těžký řetězec gama - 31 do 37, 86 až 91 a 101 -109. Tyto zbytky jsou zřejmě podílí na vzniku aktivního centra antitelVesma přirozeně v peptidových řetězců umístění imunoglobuliny vnutritsepevyh disulfidových můstků.
Video: Organizace a exprese imunoglobulinových genů 3

Každá z těchto forem smyčka dílů délkou řetězce asi 60 zbytků, a vpravo a vlevo od ní, ale má 20 zbytky. To znamená, že základní část strukturní jednotka řetězce je přibližně 100 zbytků s disulfidovým můstkem. Lehké řetězce dvou z nich a splňují V- a C-oblasti a jejich čtyři gama řetězce. V nativní řetězce každé z těchto částí je minimalizováno v oddělené, relativně nezávislé kompaktní globulí domény (Putman, 1969).
Kdo může být považováno za prokázané program IgG molekuly struktura, navržený Porter (Porter, 1973). Podle tohoto schématu, molekula je postavena z L- a H řetězce spojeny mszhtsepevymi di-sulfidové můstky. Když proteolýza (například trypsin nebo papaino.m), jak je ukázáno Porter molekuly rozdělí na tři části, z nichž dva jsou vzájemně identické a mají aktivitu protilátky (Fab-fragmenty). Skládají se z poloviny těžkého řetězce a lehkého řetězce a. Třetí fragment (Fc) se skládá z poloviny C-terminální těžkých řetězců.
Počet vazeb mezi těžkými řetězci se liší a různých podtříd lidského IgG je od dvou do pěti.
IgA se vyskytuje ve dvou formách: - monomer podobné molekuly IgG, a polymeru, je konstruován ze dvou nebo více monomerních jednotek. Makroglobulinu IgM konstruován z pěti monomerních podjednotek podobat molekulu IgG.
Video: Co je imunoglobulin Gai Co znamená imunoglobulin G znamená? Imunoglobulin G Význam
Mezi různé specificity protilátky, patří do stejné třídy (podtřídy) a typu velmi obtížné zjistit žádné rozdíly ve vlastnostech, s výjimkou jejich schopnost reagovat s antigeny. Tak, na různé antigeny, protilátky, struktura je velmi podobná, s výjimkou malé oblasti, ve které jsou v přímém kontaktu s antigenních determinant.
antigeny Stejné lze měnit látky (bílkoviny, polysacharidy, syntetické chemické látky), které mají značně odlišné konfiguraci a zdají se být umístěna ve velmi různými způsoby antigenní determinanty.
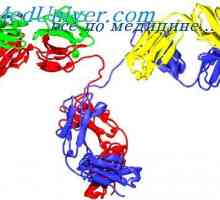 Tříd imunoglobulinů. Struktura imunoglobulinových řetězců
Tříd imunoglobulinů. Struktura imunoglobulinových řetězců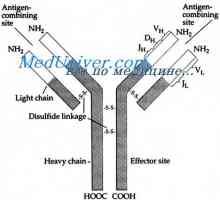 Imunoglobulin centrum g. Aktivní IgG Center
Imunoglobulin centrum g. Aktivní IgG Center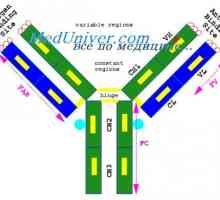 Imunoglobulin struktura g. domény IgG
Imunoglobulin struktura g. domény IgG Řízení vzdělávání imunoglobulinových lehkých řetězců. Geny světlo řetězce protilátky
Řízení vzdělávání imunoglobulinových lehkých řetězců. Geny světlo řetězce protilátky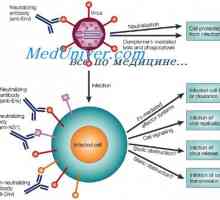 Antigenicita imunoglobulinů. Antigenní determinanty protilátek
Antigenicita imunoglobulinů. Antigenní determinanty protilátek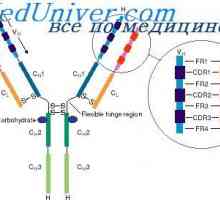 Lokalizace genů světlo řetězce protilátky. Důvody pro proměnlivosti lehkých řetězců
Lokalizace genů světlo řetězce protilátky. Důvody pro proměnlivosti lehkých řetězců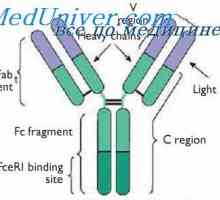 Variabilní oblasti protilátek lehkých řetězců. Geny pro variabilní oblast
Variabilní oblasti protilátek lehkých řetězců. Geny pro variabilní oblast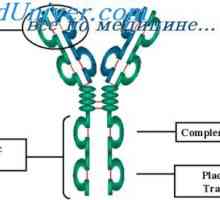 Cast lehké imunoglobulinové řetězce. Ekstrauchastki protilátky
Cast lehké imunoglobulinové řetězce. Ekstrauchastki protilátky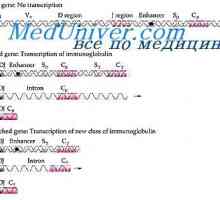 Tvorba vc-imunoglobulinových genů. Mechanismy sdružení klínové a geny protilátek
Tvorba vc-imunoglobulinových genů. Mechanismy sdružení klínové a geny protilátek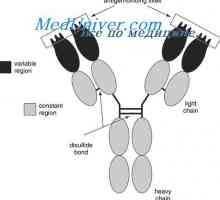 Tvorba těžkého řetězce imunoglobulinu. Konstantní oblast těžkého řetězce protilátky
Tvorba těžkého řetězce imunoglobulinu. Konstantní oblast těžkého řetězce protilátky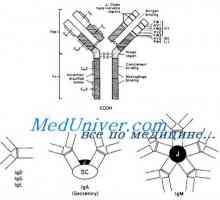 Zapletení Geny protilátky těžkého řetězce. Geny těžkých řetězců IgA
Zapletení Geny protilátky těžkého řetězce. Geny těžkých řetězců IgA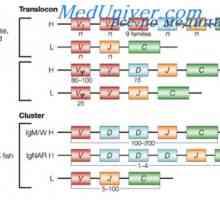 Translokon imunoglobuliny. Kombinace v- a geny protilátek
Translokon imunoglobuliny. Kombinace v- a geny protilátek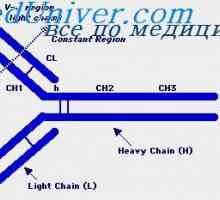 Upevňovací VH geny imunoglobulinu. Chromozom s geny protilátek
Upevňovací VH geny imunoglobulinu. Chromozom s geny protilátek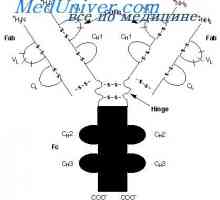 Rozdíly Variabilní oblasti protilátek. Variabilní imunoglobulinu podskupiny
Rozdíly Variabilní oblasti protilátek. Variabilní imunoglobulinu podskupiny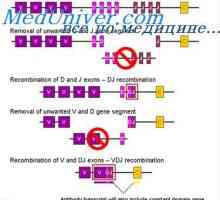 Uspořádání vc-gen. Přepínání protilátkovou aktivitu genu
Uspořádání vc-gen. Přepínání protilátkovou aktivitu genu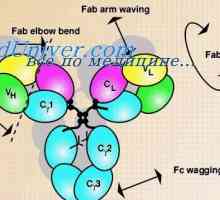 Variabilní oblasti těžkého řetězce. Variabilní oblastních genů těžkých řetězců
Variabilní oblasti těžkého řetězce. Variabilní oblastních genů těžkých řetězců Tvorba imunoglobulinových řetězcích. Přebytek protilátky syntéza L-řetězce
Tvorba imunoglobulinových řetězcích. Přebytek protilátky syntéza L-řetězce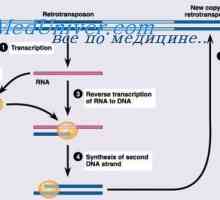 Syntéza imunoglobulinu těžkého a lehkého řetězce. Jednotná syntéza těžkých a lehkých řetězců…
Syntéza imunoglobulinu těžkého a lehkého řetězce. Jednotná syntéza těžkých a lehkých řetězců…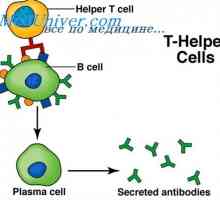 Prekurzory protilátek syntézy L-řetězec. Ekstrapeptidy a jejich funkce
Prekurzory protilátek syntézy L-řetězec. Ekstrapeptidy a jejich funkce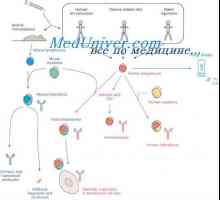 Hybridizace mRNA a DNA protilátek. Lokalizace v- a geny v genomu imunoglobulinů
Hybridizace mRNA a DNA protilátek. Lokalizace v- a geny v genomu imunoglobulinů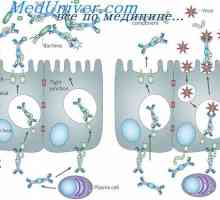 Sekrece imunoglobulinů. Fáze vylučování protilátky
Sekrece imunoglobulinů. Fáze vylučování protilátky